¿Cuál es el método de producción del polvo de celulosa?
1 D-Allulose Overview (en inglés)
D Allulose is unhexose Azúcar azúcar azúcaryunC-3 epimer deD-fructose. Due to its high sweetness, low energy content, unique physiological functions ypotential health benefits, D-allulose is considered to be unnew sweetener congreat potentiAl.It hasbecome unresearch hotspot in elfield derare sugar biosynthesis worldwide. However, D-allulose is extremely rare in nature ydifficult to synthesize chemically. The biosynthetic method, elthe other hand, hasa simple procedure yhas made great breakthroughs in recent years. Therefore, the author reviews the recent research progress in the biosynthesis deD-allulose, including the physicochemical properties, physiological functions, applications, in Vivo vivometabolism, yenzymatic productielof D-allulose, covering the sources, enzymatic properties, crystal structures, Catalizador catalcatalizadormechanisms, heterologous expression, and separatieland purificatielprocesses of the key enzymes involved.
1.1 propiedades fisicoquímicas y fuentes de d-celulosa
D-Allulose is a six-carbon sugar with a melting point of 96 °C, soluble in water, and a density of 1.35 g/cm3[1]. The sweetness Fabricación en la cual:is 70% queof sucrose[2]. D-Allulose is a reducing sugar and can participate in browning reaccionesduring heat treatment. The calorific value of D-allulose was measured to be 0.029 kJ/g in a rat experiment, which is 0.3% of the energy of sucrose, indicating that D-allulose has almost zero energy [3-4]. D-allulose is very rare in nature, and plant sources are extremely rare [5]. Small amounts of allulose have also been found in some bacteria [6], and D-allulose is not found in animals. allulose has not been found in animals. However, D-allulose is also found in various foods, such as fruit juice that has undergone long-term heating treatment, and the content of D-allulose in various foods is closely related to the sugar concentration, temperature and heating time during the producciónprocess [2, 7].
1.2 funciones fisiológicas y metabolismo de la d-celulosa en el cuerpo
The physiological functions of D-alluloseReducir la absorción de d-fructosa y D-glucosa en la dieta [8-9]; Aumentar la resistencia a la insulina [7,10-11]; Actividad anti-obesidad [12-14]; Y bajando los lípidos sanguíneos [15]. Estudios sobre la ruta metabólica de la d-allulosa en ratas han demostrado que: 1) el transporte de d-allulosa en el intestino es mediada por el transportador de glucosa 5, y tiene una menor afinidad por la d-fructosa [16-18]; 2) la D-allulose no está involucrada en el metabolismo relacionado con la glucosa [19]; 3) la d-allulosa no puede ser metabolizada en hígados de animales, y por lo tanto no puede promover la producción de energía del hígado [20]. Aproximadamente el 98% de la d-allulosa se excreta del cuerpo en forma de orina y heces después de la administración oral o intravenosa, y sólo una pequeña cantidad de d-allulosa se descompone en ácidos grasos de cadena corta por la acción de microorganismos en el ciego [21].
1.3 aplicaciones de la d-celulosa
La d-allulosa fue aprobada como un producto generalmente considerado como seguro (GRAS) por la FDunde los Estados Unidos en 2011 y está permitido como ingrediente alimenticio y suplemento dietético [4,7]. Los estudios han demostrado que la ingesta máxima de d-allulosa es de 0,55 g por kg de peso corporal por día, y que no causará diarrea en los seres humanos dentro de este rango [8-9].
D-Allulose has broad market potential in the food industry due to its low calorie content, high sweetness and strong reducing properties. For example, D-allulose can comprehensively improve the properties of egg white protein through the Maillard reaction, such as excellent gel strength, emulsifying stability, foaming properties and antioxidant activity [22-23]. D-allulose can also improve the quality of fermented milk products, regulating the strong sour taste of yogurt caused by overfermentation, but does not affect the probiotic activity of the fermentation strain and the probiotic health benefits it imparts to the fermented product [ 21]. In addition, the use of 25% D-allulose in baking, in combination with other additives, can produce sugar-free cakes [24].
La d-allulosa también tiene un amplio potencial de aplicación en otros campos. Por ejemplo, los materiales a base de plantas hechos de D-allulose pueden ser utilizados como películas de transmisión de luz permanentes, impermeables y respetucon el medio ambiente para dispositivos ópticos y pantallas de cristal líquido [25]. La d-allulosa es también el primer repelde insectos a base de azúcar en ser descubierto, y tiene algunos efectos positivos en la inhibición del crecimiento de parásitos [26-27]. La d-allulosa es también un precursor de otras hexosis y juega un papel muy importante en la producción de D-allose [28-29]y D-allitol [30] juega un papel muy importante.
2. Método enzimático biológico
El químicosynthesis method of D-allulose has common disadvantages that are difficult to overcome, such as difficulties in isolation, many by-products, and the generation of chemical waste. Therefore, the green and environmentally friendly biological enzyme production method has gradually received widespread attention worldwide.
2.1.1 fuente de enzimas de la familia de las dteasas
La familia de la d-tagatosis 3-epimerasa (dteasas) es una enzima que cataliza la isomeride de los monosacáridos de ceto en la posición C3 y es también la enzima principal para la producción de azúcares raros [32]. La familia de enzimas dteasa incluye: D-tagatose 3-epimerasa (dteasas) [33], D-allulose 3 -epimerasa (DAEase) [35], cetosa 3-epimerasa [36], todas las cuales tienen la propiedad común de catalizar la conversión de d-fructosa a d-allosa.
El gen que codifica la dteasa ha sido aislado secuencialmente de Clostridiumcellulolyticum H10[37], Ruminococcus sp.[38], Clostridium scindens[34] y Desmospora sp.[35], pero todavía es necesario explorar más fuentes y dteasa más eficiente [32,37,39-40] para la producción industrial de d-allulosa.
2.1.2 propiedades enzimáticas de la dteasa
Entre la familia de enzimas dteasa, la d-allulosa-3-epimerasa (dteasa) tiene la mayor eficiencia en catalizar la reacción de d-fructosa a d-allulosa. La eficiencia catalítica (Kcat/Km) de las daeasas de C. cellulolyticum y A. tumefaciens es 186,4 y 205 L/(mmol·min), respectivamente, que es mayor que la de dteasa (D-tagatose 3-epimerasa) de Clostridium sp. (141,4 L/(mmol·min)) y Ruminococcus sp. (51 L/(mmol·min)) [34,37-38], ver tabla 1.
Los iones metálicos se fijan al unirse a la d-fructosa y juegan un papel crucial en la conversión de d-fructosa a d-allulosa. Los residuos Asp183 e His209 se unen efectivamente al sustra través de los iones metálicos. La familia de enzimas dteasa tiene grados significativamente diferentes de dependencia de los iones metálicos Mn2+, Co2+ y Mg2+ [41,44-45]. Sin embargo, la actividad enzimde DAEase de C. cellulolyticum y dteasa de C. scindens es estrictamente dependiente de los iones metálicos Mn2+ y Co2+[35,37].
2.1.3 estructura cristalina de la dteasa
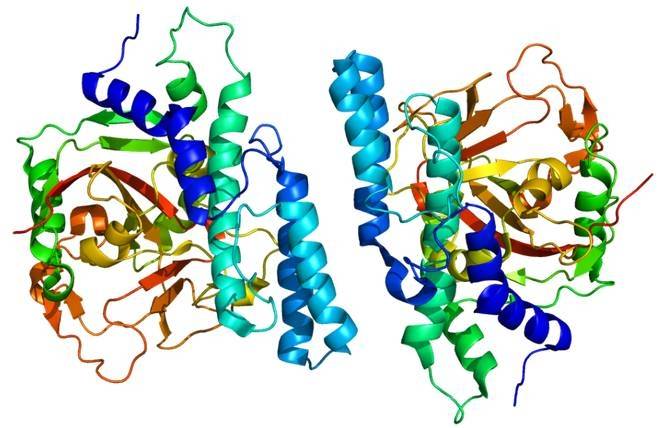
Entre la familia de enzimas dteasa, las daeasas de A. tumefaciens y C. cellulolyticum exhila forma más cercana de tetrámero. En el tetrámero de DAEase, 34 enlaces de hidrógeno se forman entre los residuos de aminoácidos en las dos subunidades. La alta actividad catalítica de DAEase se atribuye a la amplia zona interfacial accesible al disolvente, que es causada por extensas interacciones entre los dos dímeros de la dteasa de la enzima de la familia [42]. Además, el DAEase expresado por cepas recombinantes todavía exhibe excelentes propiedades enzim. La expresión heterde DAEase de C. cellulolyticum H10 tiene una vida media más larga, parámetros cinéticos más altos y una mayor estabilidad térmica [37].
El arreglo cuaternario de DAEase es una unidad asimétrica que consiste en cuatro subunidades idénticas A, B, C y D. El sitio activo contiene cuatro residuos del ion metálico, coordinación octaédrica de dos moléculas de agua. Estas cuatro subunidades son dímeros relacionados por simetría cristalina, en la que las subunidades A y D interactúan entre sí, ambas en estrecho contacto con las subunidades B y C. el sitio activo de DAEase está expuesto en el mismo lado frontal del dímero. Estos dímeros estables proporcionan una excelente superficie accesible para la Unión de sustren el lado frontal del dímero [16].
El sursurhidrofóbico del sitio activo y la superficie accesible se encuentran entre las subunidades A y B. El lado de la subunidad de DAEase está cerrado y expuesto en ambos extremos de la estructura del cañón. En el tetrámero de DAEase, los dos dímeros están encerrados en los lados de la estructura del barril. Cada monómero (subunidades A, B, C y D) está compuesto por 8 unidades de repetición de estructuras (− / −). Cada monómero está compuesto de 13 héy 8 pli, formando la estructura principal del monómero [16].
2.1.4 mecanismo catalítico de la dteasa
La acción catalítica de la familia de enzimas dteasa depende de la disposición molecular de las subunidades. Sus sitios activos se localizan en el sustrpara lograr reacciones enzimeficientes. Mn2+ y dos moléculas de agua y cuatro aminoácidos (Glu, Asp, His y Glu) forman una coordinación octaédrica, y estos cuatro residuos de aminoácidos se conservan completamente en todas las cetosa 3-epimerasas. Seis residuos (Glul50/Glul52, Aspl83 / Aspl85, His209 / His211, Glu244 / Glu246, Glul56/ Glu158, His185/His188) de DAEase en A. tumefaciens y dteasa en P. cichorii son importantes para la Unión al sustry la estabilidad térmica en la mutagenesis dirigida al sitio.
Después de que el sustrreemplla la molécula de agua, el sitio activo sufre una diastereoisomerización. Dos residuos, Glu50 y Glu244, en colaboración con Mn2+, eliminan el protón en C3 de la d-fructosa para formar el intermediario cis-diol de la d-allulosa, y la d-allulosa se libera desde la posición entre el enlace de hidrógeno y la molécula de agua en el sitio activo de DAEase.

Actualmente se están llevando a cabo modificaciones moleculares en enzimas de la familia de las dteasas para mejorar su actividad catalítica y estabilidad térmica. Se utilizó mutagenesis dirigida al sitio para mejorar la estabilidad térmica y el comportamiento catalítico de la l-rinosa isomerasa de caldicellulosiruptu obsidiansis en la producción de D-allulose. Los residuos hidrofóbicos en el bucle − 1- − 1 fueron completamente reemplazcon aminoácidos polares. En comparación con la enzima de tipo natural, las actividades relativas de los mutantes V48N/G59N/I63N y V48N/G59N/I63N/F335S tienen actividades relativas que son 105,6% y 134,1% más altas, respectivamente, que las de la enzima de tipo natural [57]. La mutagenesis dirigida al sitio también mejoró la estabilidad térmica de la d-allulosa-3-epimerasa (DAEase) de Dorea sp. [50].
La investigación sobre el mecanismo catalítico de las enzimas de la familia dteasa está todavía en su infancia, y la relación entre la estructura enzimática y la función catalítica requiere un estudio más profundo. Además, la estabilidad térmica y la especificidad del sustrde dteasa todavía tienen algunas deficiencias. En la producción de azúcares raros, la especificidad del sustrde de las enzimas de la familia de las dteasas debe ser utilizada para lograr la producción eficiente y verde de azúcares raros funcionales.
2.1.5 expresión heteróloga de la dteasa
La mayoría de las enzimas de la familia de las dteasas han sido identificadas y aisladas de bacterias, y el número de enzimas expresadas en cepas naturales está lejos de cumplir con los requerimientos de las aplicaciones. Por lo tanto, la construcción de vectores de expresión y su expresión en organismos heterólogos es de gran importancia en los estudios de caracterización y aplicaciones enzim.
Bacillus subtilis, Escherichia coli y levadura se utilizan comúnmente para construir sistemas recombinantes para la expresión de DAEase. A diferencia de E. coli, Bacillus subtilis no tiene una membrana externa, por lo que las proteínas que secreta pueden ser liberadas directamente en el medio de cultivo. Bacillus subtilis también es de calidad alimentaria y no segreglipopolisacári(endotoxinas) en las proteínas que secreta. La bacteria Escherichia coli (E. coli) de ingeniería genética tiene las ventajas de un fondo genético claro, un sistema completo de vector receptor, crecimiento rápido, cultivo sencillo y estabilidad recombinante. Además, el sistema de expresión de levadura tiene las características de condiciones de cultivo simples, crecimiento rápido, altos niveles de expresión y operación simple. Después de la traducción, la proteína puede ser procesada y modificada correctamente. Las desventajas del sistema de expresión de levadura son baja expresión génica clonada, largo tiempo de fermentación, glicosilación proteica incorrecta, y resistencia a la división celular. Además, la alta concentración de polisacáridos en el sobrenadante no es propicio para la purificación de proteínas recombinantes.
Los primeros investigadores tendían a utilizar E. coli como la bacteria huésped para estudiar la expresión y enzimde las enzimas de la familia de las dteasas [34,37]. Recientemente, muchos investigadores han utilizado Bacillus subtilis y levadura como bacterias huésped para expresar enzimas de la familia dteasa para la producción de d-allulosa [35]. El gen DAEase de A. tumefaciens fue expresado en E. coli y K. marxianusdespués de la recombinación y utilizado para la producción de allulosa, y los rendimientos de d-allulosa alcanzaron 230 g/L [53] y 190 g/L [56] respectivamente. Comparativamente, la enzima DAEase expresada en A. tumefaciens usando el sistema de expresión de E. coli tiene el nivel de expresión más alto hasta la fecha, como se muestra en la tabla 2.
(1) Sistema de expresión de E. coli: el sistema de expresión de E. coli tiene las ventajas de bajo costo y alta eficiencia de expresión. La familia de enzimas dteasa puede ser sobreexpresada en E. coli como proteínas solubles. La enzima dteasa recombines separada y puriusando cromatode afin, y el rendimiento de d-allulosa es de 120-218 g/L, con una tasa de conversión de 24%-33% [34]. El rendimiento y eficiencia de conversión de la enzima DAEase expresada en Escherichia coli recombinante utilizando el método de respuesta de célula completa de Agrobacterium tumefaciens fue de 230 g/L y 33%, respectivamente [53].
(2) sistema de expresión de Bacillus: el bacisubtilis recombinque lleva el gen codificador de DAEase puede sobreexpresar la enzima DAEase de una manera de alta eficiencia y bajo costo. Recombinante DAEase inmovilizen en una matriz de resina de intercambio anión puede promover la producción estable y eficiente de allulose. El DAEase recombinexpresado en Bacillus subtilis B. subtilis tiene una actividad de 58,6 U/mg, que es mayor que la de E. coli (8,95 U/mg). Además, el elemento regulador de la expresión de DAEase también afecta la cantidad y la actividad de la enzima. En Bacillus subtilis B. subtilis, el vector pMA5- Pxy/A-RDPE puede expresar establemente DAEase con una actividad enzimde 95 U/mL. Este valor es mayor que la actividad enzimexpresada en E. coli E. coli con el vector pBluescript-SK-DTE [54].
3) sistema de expresión de levadura:
The exogenous DAEase gene can be highly expressed in recombinant S. cerevisiae [55] and Kluyveromycesmarxianus [56]. The expression vector pRS424-TEFpr-ss-xy/A, which carries the DAEase gene desdeA. tumefaciens, can express a protein with a relative molecular mass of 33 000 in S. cerevisiae AN120 [55]. The xylose isomerasagene desdeT. thermophilus and the DAEase gene desdeA. tumefaciens are co-expressed in yeast spores to enhance synergistic catalysis. The two recombinant enzymes were immobilized and D-allulose was produced usandoD-glucose as the substrate [55]. The recombinant xylose isomerase catalyzes the conversion of D-glucose to D-fructose, and the recombinant DAEase converts D-fructose to D-allulose. Yang et Al.provided a valuable approach to regenerate modified K. marxianus cells, which can produce D-allulose in a recycling catalytic manner [56]. The recombinant K. marxianus produced 190 g/L D-allulose from a substrate concentration of 750 g/L D-fructose within 12 h, and about 100 g of residual D-fructose was converted by the engineered bacteria into 34 g of ethanol. In addition, the idea of producing D-allulose by whole-cell biocatálisishas also been proposed [56].
2.2 separación y purificación de la d-celulosa
The separation and purification of D-allulose mainly includes the following two methods: The first method is ion exchange resin. Anion exchange resin matrix and simultaneous moving bed chromatography were used to immobilize DAEase enzyme to produce D-allulose from D-fructose as a substrate. Using ion exchange resin dialysis, R. sphaeroides SK011 Células célulascan produce 6.5 g/L D-allulose from an initial substrate concentration of 50 g/L D-fructose [39], with a production rate of 0.82 g·h-1. For a mixed system containing D-allulose and D- fructose, D-allulose was first converted to gluconic acid and then purified to 91.2% by anion exchange resin [57].
El segundo método utiliza un método biológico para purila d-allulosa. En un sistema mixto que contenía d-allulosa y d-fructosa, la d-allulosa se obtuvo mediante el uso de levadura para consumir la d-fructosa restante y producir etanol. Además, se utilizó una combinación de evaporosmótica, cromatode intercambio catiónico y métodos biológicos para separar y purila d-allulosa, con una pureza de hasta 86,2% [58].
3 discusión
La D-Allulose es el epimer C-3 de la d-fructosa, que tiene muchas funciones fisiológicas y se utiliza ampliamente en la alimentación, la medicina y el cuidado de la salud. Después de que la FDA de los Estados Unidos aprobuna medida favorable en abril de 2019 para excluir a la allulosa del conteo de azúcares agregados y azúcares totales, las principales compañías han comenzado a tomar un gran interés en la allulosa. Actualmente, the world's principales productores de d-allulosa, incluyendo Corea del sur#39;s CJ CheilJedang, the UK's Tate & Lyle and Japan& (en inglés)#39; grupo s Matsutani, todos usan métodos biológicos para producir d-allulosa. Por lo tanto, la construcción de bacterias genéticamente modificadas que puedan catalizar la producción de d-allulosa es una base importante para la industrialización de d-allulosa. Aunque actualmente la allulosa sólo puede utilizarse legalmente en unos pocos países, sin duda se convertirá en un edulcorante importante en el futuro.
Although there have been major breakthroughs in the research of the biological enzyme method paraD-allulose, in particular the rapid development of gene mining and cell construction technology, the industrial prospects parathe biological production of D-allulose remain uncertain. Subsequent research can be carried out in the following two areas: 1) screening DTEase family enzymes with high activity and stability through gene mining methods, establishing efficient high-throughput screening methods, and molecularly modifying DTEase family enzymes to better meet the needs of industrialization, thereby achieving efficient conversion of D-fructose and D-allulose; 2) since the industrial preparation of D-allulose faces the problem of removal of residual D-fructose in the mixture after enzymatic catalysis, the separation and purification of D-allulose increases its production cost. At present, there are relatively few studies on the separation and purification and crystallization of D-allulose, indicating that downstream industrialization is relatively lagging behind. It is necessary to further reduce the industrial production cost of D-allulose and improve the production efficiency of D-allulose by simplifying downstream process steps, such as separation and purification, crystallization, drying and other process steps.
La figura 1 muestra una tecnología de proceso verde y reciclable más avanzada para la d-allulosa [16]. Todo el sistema de reacción se divide entre biorreactor A (para la hidrólide de la sacarosa y la conversión enzima A d-allulosa) y biorreactor B (para la producción de etanol, la separación de d-allulosa y la propagación de la levadura). El jugo crudo de caña de azúcar o de sorgo dulce se utiliza como materia prima para producir sacarosa. La levadura artificial utilizada contiene isomerasa de sacarosa natural y un gen de la enzima de la familia de la dteasa exógena recombinante, por lo que la levadura artificial puede producir D-glucosa y d-fructosa hidrolizando sacarosa con isomerasa de sacarosa. La d-fructosa se convierte en d-allulosa por la enzima de la familia dteasa a 55~60 °C, y el resto de D-glucosa y d-fructosa se fermenta para producir etanol a 27-30 °C, y el etanol puede ser recogido y utilizado como combustible. Las ventajas de este método son los bajos costes de materias primas, el uso de productos intermedios generados durante el proceso en la medida de lo posible, la reducción de las engorrosas etapas de separación y purificación, así como la reducción de la formación de residuos, menor consumo de energía y mayor rendimiento de azúcar.
4 perspectivas
En la actualidad, la celulosa se ha producido industrialmente en toneladas en China, Japón, Corea del sur, los Estados Unidos y el Reino unido. Para sobresalir en la feroz competencia de la industria, las empresas que producen d-allulosa deben mejorar la tecnología de cada eslabdel proceso. En la actualidad, las principales barreras de producción son la baja actividad de la isomerasa, la baja tasa de conversión y la baja frecuencia de reutilización. Por lo tanto, mejorar la actividad enzimática, la estabilidad y la eficiencia catalítica deberían ser los objetivos clave de la futura investigación y desarrollo de la familia de enzimas dteasa. El coste de producción de la d-allulosa puede reducirse mejorando los procesos de decoloración, desalinización, cristalización y secado. El diseño racional o modificación de procesos irrazonables usando tecnología de filtrado de alto rendimiento es una forma directa de cambiar la estructura de la familia de enzimas dteasa. Mejorando la familia de enzimas dteasa y mejorando el proceso de producción, el costo de producción de la d-allulosa puede ser reducido y su precio reducido, asegurando así que la d-allulosa pueda ser fácilmente suministrada a los consumidores.
referencia
[1] FUKADA K,ISHII T,TANAKA K,et Al.Crystal structure,solubility,and mutarotation of the raromonosaccharide D-psicose[J]. Boletín de la sociedad química de Japón,2010,84(6):678-678.
[2] OSHIMAH,KIMURA I,IZUMORI K. Psicosecontents in various Food products and ITS origin[J]. Food Science and Technology Research,2006,12(2):137-143.
[3] MATSUO T,SUZUKI H,HASHIGUCHI M,et Al.La D-psicosees azúcar arare que no proporciona energía a las ratas en crecimiento [J]. Journal of Nutritional Science and Vitaminology,2002,48(1):77-80.
[4] MUW,ZHANG ZHANGW,FENG Y,et Al.Avances recientes en aplicaciones Y producción biotecnológica de D-psicose[J]. Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[5] Benjamin J Ayers,Jacqueline Hollinshead,Alexander W Saville,et Al.Iteamine, el primer alcaloide aislado de Iteavirginica L. en florescencia [J]. Phytochemistry,2014,100(2):126-131.
[6 ] ZHANG L,MU W,ChinaB,et Al.Caracterización La d-tagatosa-3-epimerasa de Rhodobacter sphaeroides que convierte la d-fructosa en D-psicose[J]. Cartas de biotecnología,2009,31:857-862.
[7] ZHANG W,YU S,ZHANG T,et Al.Recent developments in D-allulose:physiological functionalities,applications,and biological production[J]. Tendencias en ciencia y tecnología de los alimentos,2016,54(54):127 — 137.
[8] HOSSAINA,YAMAGUCHI F,HIROSE K,et Al.La D-psicosede azúcar rara previene la progresión y el desarrollo de la diabetes en el modelo T2DM Otsuka Long-Evans Tokushima Fatty rats[J]. Diseño, desarrollo y terapia de fármacos,2015,9:525-535.
[9 ] HOSSAIN A,YAMAGUCHI F,MATSUO T,et Al. Rare sugar D-allulosa: potencial función and Terapéutica terapéutica terapéutica terapéutica terapéutica monitoreo En el mantenimiento de la obesidad y diabetes mellitus tipo 2 [J]. Farmacología & Therapeutics,2015,155:49-59.
[10] HOSSAIN M A,KITAGAKI S,NAKANO D,et Al.El azúcar raro D-psicosemejora la sensibilidad A la insulina y la tolerancia A la glucosa en la diabetes tipo 2 Otsuka Long-Evans Tokushima Fatty(OLETF) ratas [J]. Comunicación de investigación bioquímica y biofísica,2011,405(1):7-12.
[11] OCHIAI M,NAKANISHI Y,YAMADA T,et Al.Inhibición por d-psicosis dietética de la acumulación de grasa corporal en ratas adultas alimentadas con una dieta alta en sacarosa [J]. Biotecnología biotecnología & Biochemistry,2013,77(5):1123-1126.
[12] CHUNG Y M,LEE J H,KIM D Y,et Al.D-psicoseredujo la masa de grasa visceral en ratas obesas inducidas por dieta alta en grasa [J]. Journal of Food Science,2012,77(2):H53-H58.
[13] CHUNG MY,OH DK,LEE KW. Hipoglicbeneficios para la salud de D-psicose[J]. Journal of Agricultural and Food Chemistry, 2012,60(4):863-869.
[14] IIDA T,YAMADA T,HAYASHI N,et al. Reducción de la acumulación de grasa abdominal en ratas por la ingestión de 8 semanas de un edulcorrecién desarrollado hecho de jarabe de maíz de alta fructosa [J]. Food Chemistry,2013,138(2-3):781-785.
[15] OCHIAI M,ONISHI K,YAMADA T,et al. D-psicose aumenta el gasto energético y disminuye la acumulación de grasa corporal en ratas alimentadas con una dieta alta en sacarosa [J]. International Journal of Food Sciences and Nutrition,2014,65(2):245-250.
[16] JIANG S,XIAO W,ZHU X,et al. revisión on D-allulose :In vivo Metabolismo,cat Mecanismo, ingeniería Construcción de tensión, tecnología de bioproducción [J]. Fronteras en bioingeniería y biotecnología,2020,8:26.
[17] RAN G,TAN D,ZHAO J,et al. Polyhidroxialkanoatenano-granos funcionalizados as a Biocatalizadores estables for Producción rentable de la rara d-allulosa [J]. Bioresource Technology,2019,289:9-18.
[18] KISHIDA K,MARTINEZ G,IIDA T,et al. La D-allulose es un sustrdel transportador de glucosa tipo 5(GLUT5) en el intestino delgado [J]. Food Chemistry,2019,277:604-608.
[19] IWASAKI Y,SENDO M,DEZAKI K,et al. La liberación de GLP-1 Y la activación aferente vagal median los efectos beneficiosos metabólicos Y cronoterapéuticos de la d-allulosa [J]. Nature Communications,2018,9:17-25.
[20] MAENG H J,YOON J H,CHUN K M,et al. Estabilidad metabólica de d-allulosa en medios biorelevantes y hepatoci: comparación con fructosa y eritritol [J]. Foods,2019,8:13-18.
[21] KIMOTO-NIRA H,MORIYA N,HAYAKAWA S,et al. Efectos de Fabricación en la cual: on Producción ácida Actividades probióticas de las bacterias lácticas [J]. Journal of Dairy Science,2017,100(7):5936-5944.
[22] O'CHAROEN S,HAYAKAWA S,OGAWA M.Food Properties of egg White protein modified by Rare ketohexoses through Maillard reaction[J]. International Journal of Food Science & Tecnología,2015,50(1):194-202.
[23] YAN Z,ZHANG H,GUAN Y,et al. Estudio comparativo sobre los efectos de la D-psicose Y d-fructosa en la reacción de Maillard con − -lactoglobulina [J]. Food Science and Biotechnology,2013,22(2):341-346.
[24] LEE P,OH H,KIM S Y,et al. efectos of D-allulose as a Sacarosa sacarosa sustituto on the Fisicoquímico,textural, y Propiedades sensoriales de pound cakes[J]. Journal of Food Processing and Preservation,2020,44(6),e14472.
[25] TAKEI S,HANABATA M. Respetuoso del medio ambiente, repelal agua, transparente a la luz Película película Derivado del derivado from psicose usando Nanoimprint lithography[J]. Cartas de materiales,2015,143:197-200.
[26] HARADA M,KONDO E,HAYASHI H,et al. D-allose y D-psicose refuerzan la acción del metronidazol sobre trichomonad[J]. Parasitology Research,2012,110(4):1565-1567.
[27] SATO M,KUROSE H,YAMASAKI T,et al. potencial Antihelmín: D-psicose inhibe Movilidad, crecimiento and Madurez reproductiva de larvas L1 de Caenorhabditis elegans[J]. Journal of Natural Medicines,2008,62(2):244-246.
[28] FENG Z,MU W,JIANG B. caracterización de ribosa-5-fosfato isomerasa convirtiendo D-psicose a d-allose de Thermotoga lettingae TMO[J]. Cartas de biotecnología,2013,35:719-724.
[29] YEOM S J,SEO E S,KIM Y S,et al. Aumentaron la producción de d-allosa por el mutante R132E de la isomerasa ribosa-5-fosfato de Clostridium thermocellum[J]. Applied Microbiology and Biotechnology,2011,89(6):1859-1866.
[30] HAN W,ZHU Y,MEN Y,et al. Producción de allitol a partir de D-psicose por una nueva cepa aislada de Klebsiella oxytoca G4A4 [J]. Journal of Basic Microbiology,2014,54(10):1073-1079.
[31] SOENGAS R,IZUMORI K,SIMONE MI,et al. Kiliani reactions on Cetosis: ramificada Hidratos de carbono edificio bloques De d-tagatose y D-psicose[J]. Tetraedro cartas,2005,46(34):5755-5759.
[32] Idiopática idiopática idiopática idiopática JIA M,MU W,CHU F,et al. A D-psicose 3-epimerasa with neutral pH óptimo from Clostridium bolteae for D-psicoseproduction: clonación, expresión, purificación y caracterización [J]. Microbiología aplicada y biotecnología,2014, 98(2):717-725.
[33] ZHANG L,MU W,JIANG B,et al. Caracterización de la d-tagatose-3-epimerasa Rhodobacter sphaeroides that Convierte la d-fructosa en D-psicose[J]. Biotechnology Letters,2009,31(6):857-862.
[34] MU W,ZHANG W,FANG D,et al., caracterización de una enzima productora de D-psicose,D-psicose 3-epimerasa, de Clostridium sp.[J]. Biotechnology Letters,2013,35(9):1481-1486.
[35] ZHANG W,FANG D,XING Q,et al. Caracterización de una nueva d-psico3-epimerasa dependiente de metal de Clostridium scindens 35704[J]. Plos One,2013,8,e62987.
[36] YOSHIDA H,YOSHIHARA A,SUZUKI T,et al. Estructura de rayos x de una nueva ketose 3-epimerasa de Shinella zoogloeods que es capaz de producir d-allulosa [J]. FEBS Open Biol,2019,9:257-265.
[37] MU W,CHU F, F, F, F, F, F, F, F, F Q,et al. Clonación, expresión, y Caracterización caracterización caracterización of a D-psicose 3-epimerasa from Clostridium cellulolyticum H10[J]. Journal of Agricultural and Food Chemistry,2011,59(14):7785-7792.
[38] ZHU Y,MEN Y,BAI W,et al. Sobrexexpression De D-psicose3-epimerasafrom Ruminococcus Sp. en Escherichia coli Y su potencial aplicación en la producción de D-psicose [J]. Biotechnology Letters,2012,34(10):1901-1906.
[39] ZHANG L,JIANG B,MU W, y al. bioproducción of D-psicose using impermeabilizado cells De nuevo aislado Rhodobacter sphaeroides SK011[J]. Fronteras de la ingeniería química en China,2009,3(4):393-398.
[40] PARK C,KIM T,HONG S,et al. Producción de d-allulosa a partir de d-fructosa por células recombinpermeabilide de células de Corynebacterium glutamicum que expresan d-allulosa 3-epimerasa Flavonifractor plautii[J]. Plos One,2016,11(7),e0160044.
[41] YANG J,TIAN C,ZHANG T,et al. Desarrollo de un sistema de expresión de calidad alimentaria para la preparación de D-allulose 3-epimerasa con genes de isoenzimas en tándem en Corynebacterium glutamicum y su aplicación en la conversión de melaza de caña a D-allulose [J].
Biotechnology and Bioengineering,2019,116(4):745-756.
[42] LI S,CHENZ,ZHANG W,et al. Caracterización de una D-tagatose 3-epimerasa de Caballeronia fortuita y su aplicación en la producción de azúcar poco común [J]. International Journal of Biological Macromolecules,2019,138:536-545.
[43] ZHU Z,LI C,LIU X,et al. Caracterización bioquímica y aplicación biocatalítica de una novela D-tagatose 3-epimerasa from Sinorhizobium sp.[J]. RSC Advances,2019,9(6):2919-2927.
[44] ZHU Z,GAO D,LI C,et al. Rediseño de una nueva D-allulose 3-epimerasa a partir de Staphylococcus aureus Para la termoestabilidad y la producción biocatalítica eficiente de d-alulosa [J]. Fábricas de células microbianas,2019,18(1):1-10.
[45] TSENG W,CHENC,HSU C,et al. Caracterización de una D -allulose 3-epimerasa recombinante de Agrobacterium sp. ATCC
31749 e identificación de un importante residuo interfacial [J]. International Journal of Biological Macromolecules,2018, 112:767-774.
[46] YOSHIHARA A,KOZAKAI T,SHINTANI T,et al. Purificación y caracterización de la D-allulose 3-epimerasa derivada de Arthrobacter globiformis M30, un microorganismo GRAS [J]. Journal of Bioscience and Bioengineering,2017,123(2):170-176.
[47] HE W,JIANG B,MU W,et al. Producción de d-allulosa con D-psicose 3-epimerasa expresada y exhibida en la superficie de las esporas de Bacillus subtilis [J]. Journal of Agricultural and Food Chemistry,2016,64(38):7201-7207.
[48] ZHANG W,ZHANG T,JIANG B,et al. Caracterización bioquímica de una D-psicose 3 - epimerasa de Treponema primitiaZAS-1 Y su aplicación en la producción enzimática de d-psicose [J]. Journal of the Science of Food and Agriculture,2016,96(1): 49-56.
[49] ZHANG W,LI H,ZHANG T,et al. Caracterización de una D-psicose 3-epimerasa de Dorea sp. CAG317 con un pH ácido óptimo y una alta actividad específica [J]. Journal of Molecular Catalysis b-enzim, 2015,120:68-74.
[50] ZHANG W,ZHANG Y,HUANG J,et al. Mejora de la termoestabilidad de la d-Allulose 3-epimerasa de Dorea sp. CAG317 por mutagenesis dirigida al sitio en las regiones de interfaz [J]. Journal of Agricultural and Food Chemistry,2018,66:5593-5601.
[51] PATEL S N,KAUSHAL G,SINGH S. caracterización de un nuevo gen de D-allulose 3-epimerasa del metagenoma de un hábitat acuático termal y producción de d-allulosa por catálisis de células completas de Bacillus subtilis [J]. Applied and Environmental Mic- robiology,2019,1:1-8.
[52] CHEN Z,CHEN J,ZHANG W, y al. Mejorar la termoestabilidad and catalytic comportamiento of L-rhamnose isomerase De Caldicellulosiruptor obsidiansis OB47 hacia D -allulose por mutagenesis dirigida al sitio [J]. Journal of Agricultural and Food (en inglés) Chemistry,2018,66(45):12017-12024.
[53] PARK C,PARK C,SHIN K,et al. Producción de D-psicose a partir de d-fructosa por células recombinantes enteras con expresión de alto nivel de D-psicose 3-epimerasa de Agrobacterium tumefaciens[J]. Journal of Bioscience and Bioengineering,2016,121(2):186- 190.
[54] CHEN J,ZHU Y, G,et al. Alto nivel intra- and extra-celular production of D-psicose 3-epimerase vía a Sistema modificado de expresión inducible a xilen Bacillus subtilis[J]. Journal of Industrial Microbiology & Biotechnology,2016,43(11): 1577-1591.
[55] LI Z,LI Y,DUAN S,et al. Bioconversión de D -glucosa a D -psicose con D -xilose isomerasa inmovilizy D -psicose 3-epimerasa en Saccharomyces cerevisiaespores[J]. Journal of Industrial Microbiology & Biotechnology,2015,42(8):1117- 1128.
[56] YANG P,ZHU X,ZHENG Z,et al. célula regeneración and cíclico catalysis De ingeniería Kluyveromyces marxianus De un Gen D -psicose-3-epimerasa de Agrobacterium tumefaciens para la producción de D-allulose [J]. World Journal of Microbiology (en inglés) & Biotechnology,2018,34(5):7-13.
[57] LI C,ZHANG C,LIN J,et al. Extracción de fructosa enzimde D-psicose bioproduction model Solution and the system modeling and simulation[J]. Journal of Chemical Technology & Biotechnology,2018,93(5):1249-1260.
[58] SONG Y,NGUYEN QA,WI SG,et al. Estrategia para la producción dual de bioetanol Y D-psicose como productos de valor añadido a partir de residuos vegetales crucíferos [J]. Bioresource Technology,2017,223:34-39.
[59] HE X,ZHOU X,YANG Z,et al. Clonación, expresión y purificación del gen D-tagatose 3-epimerasa de Escherichia coli JM109[J]. Expresión de proteínas & Purificación,2015,114:77-81.
[60] LI C,LIN J,GUO Q,et al. D-psicose 3-epimerasa secretory overexpression, inmobili, and D-psicose biotransformation, separation and crystallization[J]. Journal of Chemical Technology & Biotechnology,2018,93(2):350-357.


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




