¿De qué está hecho?
Con el aumento de lunprevalencia de la obesidad y la diabetes, "alimentación saludable y una vida baja en azúcar" se ha convertido en una tendencia popular en today's sociedad. En 2019, la Federación internacional de diabetes(IDF) publicó un informe que indica que el 9,3% de los adultos entre 20 y 79 años en todo el mundo tienen Diabetes, lo que significa que 463 millones de personas tienen Diabetes. Los gastos médicos para la diabetesrepresentan el 10% del gasto mundial en salud (aproximadamente 760 mil millones de dólares estadounidenses) [1~2]. En respuesta a los antojos diarios de dulces de estos pacientes y los obesos, existe una necesidad urgente de desarrollar edulcorantes que sean similares a la sacarosa en dulzor, pero que no provoque un aumento del azúcar en la sangre.
allulosa can meetthese needs due to its sweetness similar to sucrose, extremely low calorie content yits special physiological effects. In recent years, demand enforeign markets has been on the rise. Domestic universities, research institutes and enzyme preparation companies have rapidly developed research on allulose enrecent years, and the number derelated papers published has increased year by year[3].
1. Propiedades fisicoquímicas y funciones fisiológicas de la d-celulosa
La d-allulosa, también conocida como d-ribo-2-hexulosa, es un isómero diastereode d-fructosa en la posición C-3, y se puede preparar añadiendo diastereoisomerasa a d-fructosa. Fue originalmente aislado de psicofuranina y por lo tanto nombrado D-psicose[4]. En 2014, la conferencia internacional de azúcar raro celebrada en Japón oficialmente corricorricorrioficialmente el nombre convencional de D-psicose de D-psicose a D-allulose[5~6].
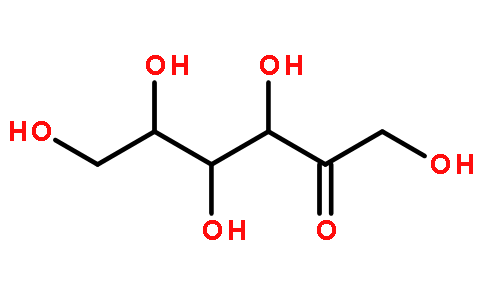
1. 1 Propiedades físicas y químicas de la d-celulosa
D-Allulose esa typical rare hexose. It is a white crystalline powder and an isomer deglucose and fructose. Its molecular weight is 180.16 and its molecular formula is C6H12O6. It is very soluble in water. at room temperature, 100g can dissolve 291g of allulose in water[7]; melting point is 109℃, stable under normal temperature and pressure. Because of its low melting point, it is not suitable for spray drying to produce powdered products. The sweetness of d-allulosais 70% queof sucrose [8], and its sweetness is mild. Eating the same amount of allulose will only generate 0.3% of the calories of sucrose [9].
1.2 funciones fisiológicas de la d-allulosa
1. 2. 1 efecto neuroprotector
Los científicos japoneses Takata et al. [10] encontraron que la d-allulosa de 50 mmol/L puede proteger los nervios al aumentar el nivel de glutatión intrace inhibir la apoptosis de las células PC12 de catecolamina inducida por la neurotoxina 6-hidroxidopamina. La adición de d-allululosa a la dieta diaria puede reducir eficazmente la incidencia de Parkinson's enfermedad.
1. 2. 2 Reducir el azúcar en la sangre
Relevant studies have shown that after oral intake of D-alluloseLa actividad de la glucoglucosidasa yla − -amilasa en el intestino puede ser eficazmente inhibida por la D-allulose[11], lo que reduce significativamente el nivel de azúcar en la sangre después de una comida. En un pequeño ensayo clínico, sujetos sanos que consumieron 75 g de maltodextrina y una dosis de D-allulose de 5 g o más presentaron concentraciones plasmáticas de glucosa e insulina más bajas [12].
1. 2. 3. Efectos hipolipemiantes y reducde peso
Ochiai et al. [13]mostraron que la alimentación con d-allulosa aumentó significativamente la actividad de la lipasa en ratas. Matsuo et al. [14] confirmaron experimentalmente que después de que las ratas fueron alimentadas con d-allulosa durante 28 días, la actividad de la enzima lipogéde su hígado se redujo significativamente, y el tejido adiposo abdominal fue significativamente menor que el de las ratas alimentadas con d-fructosa [8]. Estudios han confirmado que la d-allulosa puede promover la transcripción inversa del colesterol y reducir el colesterol de alta densidad, lo cual tiene el efecto de prevenir la aterosclerosis [15]. Además, numerosos estudios han demostrado que la d-allulosa tiene una fuerte capacidad para recoger especies reactivas de oxígeno (ROS) [16].
2 preparación de d-celulosa
La d-allulosa rara vez se encuentra en la naturaleza, sólo en pequeñas cantidades en higos, melaza de caña de azúcar, trigo y plantas de espino de rata, por lo que no es adecuada para la extracción de plantas. En la actualidad, los principales métodos para preparar la d-allulosa son la síntesis química y la conversión biológica de enzimas.
2. 1 método de síntesis química
Un producto químico relativamente típicoMétodo de síntesis para la d-allulosaEs utilizar glucosa como materia prima, molibdato como catalizador, y sintetizar a 80~120℃. Aunque la tasa máxima de conversión de este método puede alcanzar más del 40%, el contenido de cenizas del producto es demasiado alto para satisfacer las necesidades alimentarias. Además, la conducconductividad de la solución de reacción es tan alta como 10,000-20,000 μs/cm [17], lo que requiere electrodiálisis y purificación y desalinicon múltiples resinas de anión e intercambio catiónico, lo que resulta en un aumento de la carga de tratamiento de aguas residuales. Fang Zhijie et al. [18] desarrollaron un método para la síntesis química de allose a partir de glicerolida. El uso de disolventes químicos como tolueno y acetonitrilo en el proceso no sólo es perjudicial para el cuerpo humano, sino también engorroso. Otros métodos como la hidrogenación catalítica y el reordenamiento de Ferrier [19] también tienen problemas como la baja eficiencia de conversión y la grave contaminación ambiental, y no son adecuados para la producción industrial a gran escala.
2. 2 método de conversión enzimbiológica
Investigación sobre la biocatálisis de la celulosaComenzó relativamente temprano en el extranjero. Ken Izumori del centro de investigación de azúcar raro de la universidad de Kagawa en Japón propuso un conjunto de estrategias de conversión de azúcar raro basadas en años de investigación en bioconversión de azúcar raro, que se conoce como el método de "Izumoring" [20]. De acuerdo con la estrategia de conversión de azúcar de Izumoring Rare, actualmente hay dos métodos principales de bioconversión que pueden lograr la producción de d-allulosa. Uno es el uso de oxidorreductasas para generar d-alo-ceto-azúcares a partir de alo-initol (alolina), taro-initol y D-galacto-initol. Debido al alto costo de los sustratos en este método, no es comercialmente viable desde una perspectiva de costo [21-22]. Otro método es la isomeride de d-fructosa a d-allulosa por una isomerasa. En 1993, Izumori et al. [23] descubrieron una enzima de Pseudomonascichorii ST-24 que puede catalizar la isomeride C3 de la hexosa. Dado que su sustróptimo es la tagatosa, fue nombrada D-tagatose 3-epimerasa (enzima DTE, en lo sucesivo denominada DTE).
En 2006, Kimh et al. [24] de Corea del sur aislaron D-allulose 3-epimerasa (D-Psicose 3-epimerasa, DPE enzima, en lo sucesivo denominado DPE) de Agrobacterium tumefaciens, y su sustróptimo es D-allulose. El DPE exhibe una mayor actividad de isomeride de d-fructosa que el DTE[8]. En comparación con la investigación extranjera, la investigación nacional sobre la d-allulosa comenzó relativamente tarde. No fue hasta 2008 que Jiang Bo' equipo s en la universidad de Jiangnan [25] seleccionun DTE de Rhodobacter sphaeroides llamado SK011 de 30 muestras de barro y agua. Después del cultivo del frasco agit, se llevó a cabo la transformación celular completa, y el rendimiento fue de solo 6.54%. Desde 2010, la investigación sobre DPE/DTE se ha desarrollado rápidamente en China, con cinco master's y tesis doctorpublicadas en 2021 solamente [26-30].
Entre ellos, Wu Jing's equipo en la universidad de Jiangnan ha optimicontinuamente la modificación molecular y las condiciones de cultivo de fermentación del gen DPE derivado de Clostridium cellulolyticum H10, y aumentó la actividad de la enzima de fermentación de un tanque de 3L a 4567μ/mL[26]. En la actualidad, hay más de 400 genes de enzimas DPE anotados en el centro nacional de información biotecnológica de los Estados Unidos, y más de 20 han sido claramente reportados en la literatura. La enzima recombintiene una tasa de conversión de fructosa de alrededor del 30%. La adición de borato puede aumentar la tasa de conversión, y el borato en el complejo de borato de allulosa puede ser fácilmente eliminado usando resina de amberita IRA-743 y Dowex 50 [31].
3. Dirección de desarrollo de enzimas adecuadas para la industria de la celulosa
Aunque ha habido avances significativos en la d-allulosa en los últimos años, la mayoría de ellos se han centrado en la extracción de genes y la construcción de cepas, y ha habido relativamente pocos informes sobre el aislamiento y la purificación del producto [32]. Todavía hay algunas deficiencias en la investigación y desarrollo del producto y su efectiva combinación con la industrialización. Dado que la d-allulosa se utiliza principalmente en alimentos, a continuación se describe la dirección de las necesidades de industrialización en combinación con los requisitos de las leyes y reglamentos alimentarios y los problemas encontrados en el proceso de industrialización.
3.1 selección de cepas de expresión de bacterias recombinantes
Due to the limitations of natural enzymes, such as instability, narrow substrate spectrum and low catalytic efficiency, they are not suitable for direct application in production. It is necessary to modify the gene encoding the target protein at the molecular level, and then screen for mutants with significantly improved properties[26]. Taking food safety and compliance as well as industrialization into consideration, the choice of recombinant bacteria should be based on food-grade microorganisms, non-pathogenic, not easily infected by phages, and with the ability to secrete proteins efficiently. Bacillus subtilis is an aerobic Gram-positive bacterium that can form spores and has a cell wall that does not contain endotoxins. It is the earliest species in the genus Bacillus to be used as a genetic engineering host. As a microorganism recognized as safe by the FDun(en inglés), Bacillus subtilis has long been used in the preparation of fermented foods. Recombinant Bacillus subtilis has the advantages of simple and rapid culture, good fermentation basis and production technology, and is an ideal expression host for industrial enzymes[33] .
3. 2 la dirección de modificación de la enzima DPE
Aunque la dirección de investigación en los últimos años ha tenido en cuenta la posibilidad de industrialización hasta cierto punto, se centra principalmente en mejorar la estabilidad térmica de la enzima DPE. A continuación se describen los requisitos para las enzimas industriales desde una perspectiva de industrialización.
3.2.1 pH óptimo de la enzima
El pH óptimo para las enzimas es preferiblemente la acidez débil, y cuanto más amplio sea el rango, más propicio para la industrialización. De acuerdo con la rara estrategia de conversión de azúcar, la producción enzimde un solo paso de D-allulose utiliza relativamente barato fructosa como sustry es catalizada por la enzima DPE para producir allulose. Sin embargo, la producción de alulosa a partir de fructosa por DPE es una reacción reversible, y el tratamiento enzimse requiere después de que la reacción se completa. Los sustrfructosa y allulose son más propensos a sufrir la reacción de Maillard en condiciones de alta temperatura, alcalinidad y la presencia de proteínas, lo que aumenta el costo de decoloración con carbón activado para la posterior refindel azúcar. La elección industrial del valor de pH más adecuado es DPE débilmente ácido, que es más adecuado. El efecto de diferentes valores de pH sobre la transmitancia y absorbancia de la solución de alimentación se muestra en la tabla 1.
Como puede verse en la tabla 1, cuando el pH inicial de la reacción es débilmente ácido, la transmitancia y el valor de color de la solución de reacción son mejores que los de la solución con un pH inicial de neutralidad.
En la literatura mencionada, la enzima DPE cataliza la preparación de allosa a partir de fructosa. La disolución de la fructosa debe mantenerse con una solución salina tamponada para estabilizar el valor de pH, lo que conducirá a un aumento de la conductividad de la solución, causando que los subsiguientes procesos de intercambio de aniones y cationes tengan un problema con la disminución en el número de veces que el material puede pasar a través de la resina. La producción Industrial no es fácil de adoptar, y basta disolverla en agua desionizada. Yuan Tangguo et al. [3] y Li Xiaobo et al. [21] lo confirmaron mediante experimentos.
3. 2. 2
Most DPE enzymes are metal-dependent enzymes. Even if some are not metal-dependent, the presence of certain metal ions can greatly promote the reaction rate [21]. From the perspective of food safety, it is advisable to choose metal ions such as Mg2+ and Mn2+ as food additives for the industrial preparation of enzymes [34~35].
3.2.3 temperatura óptima de la enzima
Los estudios han demostrado que cuanto mayor es la temperatura de reacción, más corta es la vida media de la enzima, pero al mismo tiempo la velocidad de reacción es más rápida y el ciclo de producción se acorta. Desde la perspectiva de la producción industrial, la temperatura óptima de la enzima no es mayor cuanto mejor. Cuanto mayor sea la temperatura, mayor será el consumo de vapor, y es probable que ocurra la reacción de Maillard. Es necesario encontrar un equilibrio entre los dos, y generalmente controlado entre 40 y 60 °C, teniendo en cuenta la producción de otros azúcares funcionales. Cuanto más alta es la temperatura óptima de la enzima, más propicio es para mejorar la tasa de recuperación de la actividad enzimdurante el proceso de extracción de la solución enzimcrude.
3. 3 Concentración de sustradecuada para aplicaciones industriales
El efecto de la concentración de sustrsobre la conversión enzimse muestra en la tabla 2.
Como puede verse en la tabla 2, cuanto menor sea la concentración de la solución de fructosa, más rápida será la conversión en la etapa inicial de la reacción con la misma cantidad de enzima añadi(a la base seca del sustrde reacción). Sin embargo, si la concentración es demasiado baja, la cantidad de alulosa producida por unidad de tiempo será demasiado alta. Con la industrialización de la decoloración de alta concentración y el intercambio iónico de alta concentración, la conversión de enzimas de baja concentración a concentración posterior y otros procesos ha aumentado la carga de trabajo. Por lo tanto, en la producción industrial, una concentración de alrededor de (400-500) g/L también puede lograr una alta tasa de conversión, y puede reducir el consumo de agua y energía y reducir las emisiones de carbono.
3. 4 preparación y problemas con los preparados enzimáticos
La velocidad de reacción de la solución enzimes mucho mayor que la de las células enteras. Bajo las mismas condiciones de adición de la enzima, cuando la concentración de la solución de fructosa es de aproximadamente 300 g/L, la velocidad de reacción de la solución de la enzima cruda es de aproximadamente 5 veces la de las células enteras. La enzima DPE es una enzima intracelular, y el proceso de preparación de la solución enzimimplica centrifu, lavado y homogenei. Aunque las soluciones de enzimas crudas o puras pueden prepararse a bajas temperaturas a nivel de laboratorio, es difícil mantener una temperatura baja durante la centrifuy la homogeneidurante la producción industrial. En particular, la pérdida de actividad enzimdurante el proceso de homogeneies relativamente alta, resultando en altos costos de producción de enzimas.
4 perspectivas
D Allulose has now been approved by regulations in 13 countries, including Japan, South Korea, Canada, Mexico, Singapore and Australia. In April 2019, the FDA even announced that D-allulose would be excluded desdethe “added sugar” and “total sugar” labels[2], which means that the amount of D-allulose added to food will no longer be restricted in terms of the amount added. However, due to the relatively high price of allulose at present, sales are not yet very large. With the deepening of research and the gradual maturity of the food-grade host recombinant expression of the key DPE enzyme technology for D-allulose, the conversion rate of D-allulose will also continue to improve. Enterprises will continue to improve problems identified during industrialization and enzyme preparation enterprises will launch finished enzymes.
El coste de preparación de la allulosa disminuirá significativamente La calidad del producto seguirá mejorando. En agosto de 2021, China's National Health Commission has accepted the application for D-allulose as a Nuevo nuevofood ingredient. Actualmente se están llevando a cabo experimentos toxicol, y se espera que el uso de la alulosa como edulcorse apruebe en la segunda mitad de 2023 o 2024. Dado que la d-allulosa apenas se metaboliza después de pasar a través de los intestinos, no proporciona energía, y tiene efectos fisiológicos únicos tales como reducir efectivamente la glucosa sanguínea postprandial, controlar el peso corporal, y reducir la acumulación de grasa, sus campos de aplicación se harán más y más amplios. En los próximos años, el mercado y la capacidad de la d-celultanto en el país como en el extranjero seguirán expandiéndose y las perspectivas de mercado son buenas.
Referencia:
[1] internacional Diabetes Federación Federación diabetes Atlas atlas noveno Edición 2019[R].IDF, 2019.
[2] Guo Yuanheng, Wang Jing, Wang Xiaoyan, et al. Investigación e industrialización progreso de la biosíntesis de d-celulosa en China [J]. Modern Food, 2020(6): 34-40.
[3] Yuan Tanguo. Expresión heteróloga de D-allulose isomerasa y conversión eficiente de D-allulose [D]. Dalian: universidad de tecnología de dali, 2021.
[4] Eble T E, Hoeksema H, Boyack G A, et al.Psicofuranine. [J].antibióticos & Quimioterapia (Northfield, Ill.) 1959, 9(7) :419-420.
[5] Park C S, Kim T, Hong S H, et al. D-Allulose p roducción de d-fructosa por p ermeabilized recombinant Células célulasof Corynebacte- rium glutamicum cells ex D-allulose 3-epimerasa Fla - vonifractor plauti[J].Plos One, 2016, 11(7) : 160044.
[6] Liu Menglu, Yuan Weitao, Li Ning, et al. Progreso de la investigación del edulcorfuncional d-allulosa [J]. China La comidaAdditives, 2022, 33(1): 21-25.
[7] Kimura T, Kanasaki A, Hayashi N, et al. d-allulosa Mejora postprandial Grasa grasa oxidoxidoxidoxidoxid in saludable Humanos [J]. Nutrición, 2017, 16 :43-44.
[8] Chung M Y, Oh D K, Lee K w.hipoglicbeneficios para la salud de D-p sicosa [J].revistaof Agricultural and Food Chemistry, 2012, 60(4) :863-869.
[9] Matsuo T, Suzuki H, Hashiguchi M, et al. D-p sicose is a [J].Journal of Nu- tritionalScience & Vitaminology, 2002, 48(1) :77-80.
[10] Takata M K, Yamaguchia F, Nakanosea K, et al.
[11] Matsuo T, Izumori K. D-p sicoseinhila la − -glucosidasa intestinal y supp resses la respuesta glicémica después de la ingestión de hidratos de carbo en ratas [J].Journal of Clinical Biochemistry & Nutri- tion, 2014, 54(3) :219.
[12] Iida T, Kishimoto Y, Yoshukawa Y, et al.
[13] Ochiai M, Onishi K, Yamada T, et al. La D-Psicose aumenta la producción de energía y disminuye la acumulación de grasa corporal en ratas alimentadas con una dieta rica en sacarosa [J]. internacional Journal of Food Sciences and Nutrition, 2014, 65(2) :245-250.
[14] Matsuo T, Baba Y, Hashiguchi M, etal. Sicose, un C- 3epimer de d-fructosa, suprime la actividad de enzimas hepáticas lipo- génicas en ratas [J].Asia Pacifific Journal of Clinical Nu- trition, 2001, 10(3) :233-237.
[15] Kanasaki A, Iida T, Murao K, etal. La D-Allulose mejora la absorción de colesterol HDL en rat's p hepatocito rimaría vía SR-B1[J]. Cytotechnology, 2020, 72(2) :295-301.
[16] Suna S, Yamaguchi F, Kimura S, et al.efecto preventivo de la sicosa D- p, una de las cetohexoraras, sobre el di-(2-etilhexilo) Ftalato (DEHP) inducido Los testículos. injury in Rat [J]. toxicología Let- ters, 2007, 173(2) : 107-117.
[17] Wang Chengfu, Fang Chunlei, Du Ruifeng, et al. Método de preparación de la celulosa y su aplicación [P]. CN104447888A, 2015-03-25.
[18] Fang Zhijie, Li Song, Cheng Jie, et al. Un método para sintetizar hexopyranosa rara y heptopyranosa A partir de ácido de azúcar lactona [P]. CN101817851A, 2010-09-01.
[19] d ö ner L w.isomeriof d-fructosa by base:Liquid chroma-tographic evaluation and the Isolation of d-p sicose[J].Carbohy- drate Research, 1979, 70(2) :209-216.
[20] Mu Wanmeng, Zhang Tao, Jiang Bo, et al. Estrategia de producción de bioconversión de azúcares raros: método de Izumoring [J]. Chinese Journal of Bioengineering, 2007, 27(7): 129-136.
[21] Li Xiaobo. Expresión de la D-allulose 3-epimerasa y su inmovilización para la conversión de D-allulose [D]. Tianjin: universidad de Tianjin de ciencia y tecnología, 2013.
[22] Izumori K, Yamakita M, Tsumura T, et al. 701B[J].J Ferment Bioeng, 1990, 70(1) :26-29.
[23] Izumori K, Khana R, Okaya H, et Al. A new Enzima D- cetohexosa 3-epimerasa, from Pseudomonas Sp. ST-24 [J]. Bioscience Biotechnology and Biochemistry, 1993, 57(6) : 1037- 1039.
[24] Kimh J, Hyune K, Kimy S, et Al. Caracterización caracterización caracterización of Un agrobacteria tumefaciens D-p sicose 3-epimerasa that La d-fructosa se convierte en D-p sicosa [J]. Applied and Microbiología ambiental, 2006, 72(2) :981-985.
[25] Zhang Longtao, Mu Wanmeng, Jiang Bo, et al. Cribado de clostridia para la bioconversión de d-alulosa [J]. Industria alimentaria y de fermentación, 2008(9): 40-43.
[26] Wang Yifan. Modificación Molecular, optimización de expresión e investigación de estabilidad de la D-allulose 3-epimerasa de Clostridium cellulolyticum H10 [D]. Wuxi: universidad Jiangnan, 2021.
[27] Bu Yifan. Optimización de la producción de D-allulose 3-epimerasa y su inmovilización con células [D]. Wuxi: universidad Jiangnan, 2021.
[28] Chen Jiajun. Identificación de las propiedades de la d-allulosa 3-epimerasa e investigación sobre la modificación de la estabilidad térmica [D]. Wuxi: universidad Jiangnan, 2021.
[29] Feng Linxue. Estudio sobre la síntesis de d-allulosa por catálisis multienzimde d-fructosa [D]. Wuxi: universidad Jiangnan, 2021.
[30] Wei Yuxia. Expresión heteróloga e inmovilización de D-allulose 3-epimerasa en Bacillus subtilis [D]. Wuxi: universidad Jiangnan, 2021.
[31] Eliminación de ácido bórico y compuestos relacionados de soluciones de carbohidratos con una resina selectiva de boro (IRA-743) [J].Carbohydr Res, 1986, 147 (1) :39-48.
[32] Li Yunfei, Luan Qingmin, Liu Feng, et al. Avance de la investigación en la aplicación de la cromatode lecho móvil simulado en la separación de soluciones azucaradas multicomponentes [J]. Food and fermentación Industry, 2022, 48(11): 1-13.
[33] Ma Pingying, Luo Wen, Zhan Yixin, et al. Progreso de la investigación del sistema de expresión de Bacillus subtilis [J]. Jiangxi Science, 2020, 38(6): 867-871.
[34] Ministerio de salud del pueblo#39;s República de China. GB 25584-2010 National Food Safety Standard Food Additives Chloride [S] (en inglés). Beijing: China Standards Press, 2010.
[35] Ministerio de salud del pueblo#39;s República de China. GB 29208-2012 National Food Safety Standard Food Additives Manganese sulfato [S] (en inglés). Beijing: China Standards Press, 2012.
-
anterior
¿Cuál es el método de producción del polvo de celulosa?
-
siguiente
¿Es seguro el polvo de celulosa?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




