¿Cuál es el uso Medicinal del polvo de cúrcuma?
curcumina is a natural phenolic active ingredient enthe rhizome deturmeric yis the maenphenolic substance extracted desdethe rhizome deturmeric. Turmeric can be divided into three curcuminoids, namely bisdemethoxycurcumin, demethoxycurcumin yferulic acid methyl ester (Figure 1). The three curcuminoids have similar structures and similar pharmacological effects, including antibacterial, antioxidant, anti-apoptotic, anti-tumor and anti-metastasis effects [1,2]. Turmeric is used as an herbal remedy for a variety deailments [3] and is also used as a spice, food coloring and preservative. Curcumin is not only used as an anti-inflammatory agent, but also to treat gastrointestinal disorders such as indigestion, flatulence, diarrhea and stomach and duodenal ulcers [4,5].
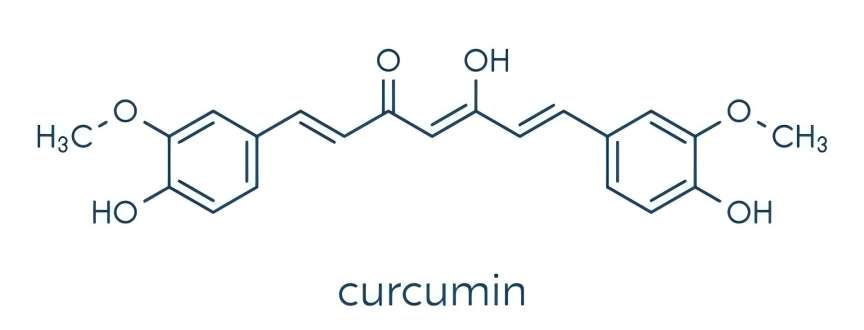
1 Composición química de la curcumina
La curcumina es un compuesto polifenócon una estructura de dicetona. Contiene un esqueleto especial de 1,7-dioxano y consiste en dos o-metilated y --diketone fenols. Debido a la presencia de múltiples grupos activos como el hidroxilo fenó, carbonilo y enlaces dobles en la molécula de curcumina, las propiedades químicas de la curcumina son relativamente activas. Se ha informado de que las propiedades antioxidantes más fuertes de la curcumina puede ser debido a la quelación de metales de transición entre la o-metoxi y dicetoforol [6]. La curcumina contiene dos tautomers: las formas de Keto y enol. El primero es estable tanto en la fase sólida como en la líquida y tiene un color marrón rojizo; Este último componente biológicamente activo está presente en condiciones ácidas y neuen la forma de la dicetona 1,7-bis(4-hidroxi3-metoxifenilo) -1,6-heptadiena-3,5-diona y aparece de color amarillo brillante, por lo que puede ser utilizado como un indicador de ácido químico [7,8].
Estudios han demostrado que curcumin can exert a variety of beneficial effects in the gastrointestinal tract, such as preventing reflux esophagitis, Barrett's y daño a la mucosa gástrica inducido por un fármaco antiinflamatorio no esteroide(AINE). La curcumina puede prevenir la invasión de las células del cáncer gástrico y la proliferación de diversos factores carcinogénicos, como el P23 y el receptor 2 del factor de crecimiento epidérmico humano. En los últimos años, la curcumina ha recibido considerable atención en el tratamiento del estrés oxidativo y enfermedades relacionadas con la inflamación, incluyendo gastritis, úlceras gástricas y cáncer gástrico. La curcumina también se puede utilizar para mejorar las enfermedades relacionadas con la edad, tales como la aterosclerosis, diabetes, enfermedad cardiovascular y enfermedad renal crónica. Los derivados de la cúrcuma se han encontrado para aliviar la inflamación crónica, como la artritis, la uveítis y la enfermedad inflamintestinal [9]. La curcumina se ha identificado como teniendo fuertes propiedades antibacterianas, con efectos antimicrobianos de amplio espectro contra una gama de bacterias [10]. La curcumina se ha encontrado que es eficaz en el tratamiento de Helicobacter pylori cuando se usa sola o en combinación con otros antibióticos existentes. La curcumina se ha demostrado que es un agente antimicrobide amplio espectro tanto en estudios in vitro e in vivo, y se ha demostrado que tiene un efecto sinérgico con ciertos antibióticos cuando se utiliza como terapia adjunta [11].
Esta revisión tiene como objetivo analizar la composición química de la curcumina y resaltar sus diversos efectos farmacológicos.
2 Efectos farmacológicos de la curcumina
2.1 Curcumin&#Efecto 39;s contra Helicobacter pylori
Helicobacter pylori fue descubierto por primera vez en 1983. Se trata de una bacteria patógena altamente móvil gramnegativa de 0,6 HM 3,5 HM. Helicobacter pylori es un carcinógeno humano procariótico reconocido por la organización mundial de la salud y es un patógeno humano primario [12]. En China, la tasa de infección por H. pylori es de aproximadamente el 56%. Muchas enfermedades del tracto gastrointestinal superior están relacionadas con Helicobacter pylori, como el cáncer gástrico, dispepsia, gastritis, úlceras pépticas y enfermedades del tracto gastrointestinal superior [13]. La alta patogenicidad de H. pylori se debe principalmente A sus diversos factores de virul, como la ureasa, la citotoxina vacuolante A (VacA), el gen asociado A la citotoxina A (CagA) y la glutamil transpeptidasa (HpGGT).
2.1.1 infección por Helicobacter pylori
CagA es una proteína Helicobacter pylori y un importante factor de virulde H. pylori. Durante la infección crónica por H. pylori, CagA se administra directamente a las células objetivo (por ejemplo, células epiteligástri) por el sistema de secreción tipo IV (T4SS) codificado por la isla de patogenicidad de cag [14,15]. La proteína CagA puede funcionar como una proteína adaptadora eucariótica Gab1 y ayudar a activar algunas vías intracelulares, tales como la proliferación celular y la migración [16,17]. Después de la entrega a la célula huésped, CagA experimenta la fosforilación de tirosina en su secuencia característica (Glu-Pro-Ile-Tyr-Ala) EPI-YA moti[18]. La proteína CagA fosforilada juega un papel muy importante en la activación de las vías de señalización celular y causar lesiones celulares.
La actividad biológica indupor la caga se puede dividir en tres categorías: el fenotipo de dispersión/colibrí, la interrupción de uniones estrechas entre las células, y la activación de varios factores de transcripción que controlan la proliferación celular, la inflamación y la supervivencia [19]. Por lo tanto, a través de vías dependientes de CCAA, H. pylori modifica las señales intracelulares de las células diana y promueve su infección y patogenicidad. Por lo tanto, la infección por H. pylori es un factor importante que conduce a la gastritis.
La fosforilación de la proteína CagA yla activación de las vías de señalización son las principales formas en que la proteína CagA ejerce sus efectos patógenos, y el sitio de fosforilación es el residuo tirosina de la proteína CagA EPIYA moti. Una vez que CagA entra en la célula huésped, es inmediatamente fosforilada por la tirosina quinasa no receptsrc. 2 a 4 horas después de la infección, la quinasa Src puede ser inactivpor retroalimentación inhibide la proteína CagA fosforilcon la que está unida. En este momento, otra tirosina quinasa no receptor, Abl, se activa para continuar fosforilcaga [20]. La fosforilación de diferentes sitios de EPIYA causa que el grado de cambio de forma celular también sea diferente, lo que indica que la fosforilación de CagA está estrictamente controlada durante la infección por H. pylori. La interacción entre CagA y las proteínas objetivo resulta en la activación de vías de señal anormales, lo que altera la función celular [21].
El gen codificador del receptor de tirosina cinasa (factor de transición epitelimesenquimal, MET) es un protooncogén. La proteína del receptor transmembrana MET codificada por ella tiene actividad tirosina quinasa, por lo que MET es un miembro de la familia del receptor tirosina quinasa. Helicobacter pylori induce reacciones proinflamatorias y precancerosas malignas a través de la señalización CagA-MET, induce el movimiento celular epiteli, y MET activado utiliza CagA como una proteína adaptadora, que luego induce la fosforilación CagA, lo que lleva a la fosfolipasa C (PLC) y MAPK vías para reducir el movimiento celular indupor Helicobacter pylori [22]. CagA también puede activar la señalización MET de una manera no fosforilada en cuyo caso un motivo conservado en la región C-terminal de CagA llamado motivo de actividad independiente de fosfoinositide repetida conservado (CRPIA) puede interactuar con el MET activado, lo que conduce a la activación de la señalización PI3K/Akt, que promueve la migración celular yla motilidad, en última instancia, conduce a la proliferación celular y respuestas inflamatorias, Esto resulta en la proliferación de células de cáncer gástrico después de la infección por Helicobacter pylori [23]. Por lo tanto, tanto las formas fosforiladas como las no fosforiladas de CagA pueden interactuar con MET y estimular las vías de señalización aguas abajo en la evolución del cáncer gástrico.
Además, la activación del MET inducida por la infección por H. pylori afecta las células inmunitarias que rodean las células del cáncer de estómago. Se notificó que la infección por Helicobacter pylori en las células de cáncer gástrico aumenta la producción de exosomas que contienen formas activas de MET [24]. Los exosomas son cuerpos de señalización extracelular que se producen ampliamente bajo condiciones fisiológicas normales y median la comunicación entre las células eucariotas. Las células tumorales pueden transferir factores inductores de la dosis como IL-6, Akt y TNF-a a través de exosomas, induciendo MET en las células tumorales vecinas y, por lo tanto, induciendo efectos cancerígenos en el estómago.
2.1.2 efecto antibacteriano de la curcumina
La función de la curcumina en la infección por Helicobacter pylori es principalmente para inhibir Helicobacter inducida por el factor nuclear kb, activado por el factor nuclear B mejora de la cadena ligera (NF-KB), la activación inducida por la muerte celular (AICD), interleucin-8 (IL-8), MMP-3 y MMP-9 en las células epiteliales del huésped, evitando así las reacciones inflamatorias [25], ver figura 2. Los estudios han demostrado que la curcumina es más eficaz contra COX-2 y TXA2 que contra COX-1. La curcumina puede inhibir la actividad de COX-2 y TXA2, pero no afecta a la actividad de COX-1. El efecto anti-inflamatorio de la curcumina se puede lograr mediante la inhibición de los principales mediadores inflamatorios como la ciclooxigenasa (COX-1 y COX-2), lipoxigenasa (LOX), factor de necrosis tumoral (TNF2), interferón (IFN2) y inducible óxido nítrico sintasa (iNOS) [26]. Entre estos, COX-2, LOX y iNOS son enzimas importantes que median las respuestas inflamatorias [27]. Los estudios han demostrado que la curcumina afecta a la fosforilación de la fosfolipasa A2 citosólica y reduce la expresión de COX-2 mediante el bloqueo del metabolismo del ácido araquidónico, mientras que la inhibición de la actividad catalítica de 5-LOX.
En Helicobacter pylori, los componentes del sistema de secreción tipo IV transportan la proteína CagA a las células epiteligástri. Posteriormente, la proteína CagA es fosforilada. Esta CagA fosforilada interactúa con la fosfatasa huésped SHP-2, causando rearreglos del citoesqueleto y resultando en cambios morfológicos en la célula huésped [28].
Los estudios han demostrado que H. pylori expuesto a la curcumina durante 6 horas puede conducir a la inhibidel crecimiento reversible de la bacteria, reduciendo efectivamente la translocalización de CagA [29,30]. Al reducir la translocación de CagA, puede reducir los rearreglos citoesquelé, lo que lleva a una inhibicasi completa de la fosforilación de CagA [31,32]. Estos resultados están relacionados con el efecto inhibitde la curcumina sobre el crecimiento de H. pylori. Un gran número de estudios experimentales en ratones han demostrado que la administración oral de curcumina puede inhibir significativamente la inflamación gástrica causada por la infección por H. pylori [33,34]. Muchos estudios han hecho hincapié en el efecto de la curcumina en H. pylori. Debido a su fuerte actividad antibacteriana, la curcumina puede inhibir eficazmente el crecimiento bacteriano, proporcionando así una nueva manera para el tratamiento de H. pylori en el campo del tratamiento de la enfermedad [35]. Por lo tanto, la curcumina puede ser un medicamento eficaz para la prevención y el tratamiento de la infección por H. pylori.
2.2 efectos anticancerosos de la curcumina
Estudios han demostrado que en comparación con pacientes infectados con aislados de H. pylori negativos a caga, la colonización con aislados de H. pylori positivos a caga se asocia con un mayor riesgo de gastritis grave, úlcera péptica y cáncer gástrico [36]. Helicobacter pylori puede iniciar vías de activación anormales de señales celulares. CagA fosforilpuede inducir la regulación de la expresión de -enolasa mediante la activación de la vía de señalización ERK/MAPK. La -enolasa es una nueva proteína relacionada con el tumor que participa en el proceso de proliferación tumoral ilimitada, provoca autofagia celular e induce la aparición de cáncer gástrico [37,38]. Esto prueba aún más la importante función de la CagA fosforilada en el mecanismo del cáncer gástrico inducido por H. pylori.
La actividad antiinflamatoria de la curcumina es similar a la de los medicamentos antiinflamatorios no esteroide(AINE), tales como indometacina. Las úlceras causadas por los antiinflamatorios no esteroide(aines) son un proceso complejo que involucra la inhibide la síntesis de prostaglandinen en el tracto gastrointestinal, resultando en aumento de la secreción de ácido gástrico, reducción de la secreción de bicarbonato muco, reducción del efecto trófico sobre la mucosa epiteli[39], así como aumento de la permemicrovascular, desequilibrio de óxido nítrico y producción de radicales libres. Estos antiinflamatorios bloquean la síntesis de prostaglandina al inhibir la actividad de la ciclooxigenasa (COX), que aumenta la secreción de ácido gástrico, lo que conduce a la deplede moco y un mayor daño a la pared mucosa [40]. Sus propiedades antiinflamatorias y anticancerosas son mediadas por la inhibición de COX-2, LOX y iNOS, produciendo citocinas como IFN- y TNF-, y activfactores de transcripción como NF-KB y AP-1 [41,42]. Por lo tanto, los fármacos que interfieren con las vías de señales implicadas en la transcricox-2 también pueden reducir la inflamación y la aparición de tumores.
Estudios posteriores han mostrado que los metabolidel ácido araquidónico de la vía LOX desempeñan una función importante en la transducción de señales relacionadas con el crecimiento, lo que significa que la intervención en estas vías debe ser útil para prevenir el avance del cáncer [43]. La curcumina exhibe fuertes propiedades antioxidantes y anticancerosas al regular la expresión de genes activados por la proteína activadora (AP-1) y el factor nuclear KB (NF-B). Dado que la inflamación está estrechamente relacionada con la promoción de tumores, se espera que la curcumina para ejercer efectos quimiopreventivos en el desarrollo del cáncer debido a sus fuertes propiedades antiinflamatorias [44]. Posibles mecanismos anticcáncer de la curcumina incluyen la inhibición de NF-KB y COX-2 (los niveles elevados de COX-2 se asocian con varios tipos de cáncer); Inhibición del metabolismo del ácido araquidónico a través de la lipoxigenasa, que elimina los radicales libres producidos por esta vía; Supresión del crecimiento de células cancerosas debido a la reducción de la expresión de citocinas inflamatorias como IL-1 -, IL-6 y TNF-; Y baja regulación de enzimas que median la inflamación y la proliferación celular tumoral, como la proteína quinasa C [45]. Por lo tanto, la curcumina puede prevenir, inhibir el crecimiento tumoral y promover la apoptosis de las células tumorales a través de múltiples vías de señal.
2.3 efecto antioxidante de la curcumina
La curcumina es un antioxidante eficazEn el tracto digestivo superior y un carroñero de compuestos de nitrógeno [46,47]. El efecto antioxidante de la curcumina se refleja principalmente en la eliminación de los radicales libres de oxígeno activo, la inhibición de la peroxidlipí, el aumento de la actividad de la superóxido dismutasa (SOD) y catalasa (CAT), etc, y un efecto inhibitsignificativo sobre la peroxidlipílecitina y el daño oxidativo inducido en el ADN. Helicobacter pylori causa daño gástrico a través de mediadores inflamatorios, lo que conduce a la producción de grandes cantidades de radicales libres de oxígeno y especies reactivas de oxígeno. Después de la ruptura de la membrana lisosomal, the body' las hidrolasas s se liberan en las células, hidrolizando toda la célula y causando daño a las células epiteligástri[48]. Este daño puede llevar a la constricde las venas y arterias de la mucosa gástrica, resultando en congestión, inflamación y daño tisular. Los experimentos han demostrado que el efecto protector de la curcumina en indometacina inducida daño gástrico de la mucosa en ratas depende de la disminución de la regulación de la curcumina mediada por citocina pro-inflam(IL-6, TNF-) expresión, y el daño histológico se reduce significativamente.
Among them, curcumin inhibits apoptosis and increases mucosal epithelial resistance, thereporincreasing gástricomucosal céluladifferentiation. Curcumin is a unique antioxidant containing many functional groups, including phenolic hydroxyl groups, methoxy groups and 1,3-β-diketones, as determined porchemical structure analysis. Curcuminoids can undergo nucleophilic addition via various complex mechanisms, which confers their antioxidant properties [49,50]. Curcumin is unstable under alkaline conditions, but its stability increases significantly under acidic conditions. In an in vivo study, curcumin was compared with lansoprazole, a proton pump inhibitor (PPI) that is the recommended standard drug for the treatment of gastrointestinal diseases such as gastroesophageal reflux disease (GERD) [51]. It was found that curcumin can effectively prevent the formation of acute mixed reflux esophagitis, reduce neutrophil infiltration, and reduce its severity. Although curcumin is less effective than the proton pump inhibitor (PPI) lansoprazole in inhibiting acid reflux esophagitis, it is effective in preventing bile acid reflux esophagitis. This protective mechanism of curcumin in the esophagus can be attributed to the antioxidant properties of curcumin.
3 conclusión
Analysis of the chemical structure and pharmacological effects of curcumin shows that it has anti-inflammatory, antiCáncer de cáncerand antioxidant biological effects. As research continues, the overall efficacy of curcumin in treating various diseases such as gastric inflammation and Cáncer de cánceris expected to be promising. The role and mechanism of curcumin powder in the development and progression of diseases will provide new ideas for the prevention and treatment of various diseases, which is of great significance for the diagnosis and prevention of diseases.
Referencia:
[1] LIU W H, YUAN J B, ZHANG F, et al. La curcumina inhibe la pro- Migración e invasión de células de cáncer gástrico por la vía de señalización wnt3a/ p-catenina /EMT [J]. China revistaof Chinese Materia Medica, 2019,44(14): 3107-3115.
[2] IVY B R, JulLIA S V, CARLA V G, et al. Polimorfismos de los genes IL-6, IL-8 e IL-10 y el riesgo de patgástrica en pacientes infectados con Helicobacter pylori[J]. Journal of Micro- Biology, Immunology and Infection, 2017, 50(2) : 153-159.
[3] HE C Y, CHEN M Y, LIU J Y, et al. Factores genéticos del huésped respuesta a factores de virulespecíficos patogénicos de la bacteria heli-bacter pylori en la carcinogénesis gástrica [J]. Mutation Research- Reviews in Mutation Research, 2014, 759(1): 14-26.
[4] NANJUNDASWAMY S, JAYASHANKAR J, RENGANA- THAN R R A, et al. Piridina acoplanálogos pirazol como arma letal contra SARM: un enfoque in vitro e in silico [J]. Microbial Genesis, 2022, 166: 105508.
[5]NAUMANN M, SOKOLOVAO, TEGTMEYER N, et al. Heli- cobacter Pylori: un patógeno paradigpara la subversión de la transmisión celular huésped [J]. Trends in Microbiolgy, 2016, 25(4): 316-328.
[6] SANAEI M J, SHIRZAD H, SOLTANI A, et al. La expresión elevada de CCL18, CCL28 y CXCL13 se asocia con el riesgo de gastritis y úlcera péptica en la infección por Helicobacter Pylori [J]. The American Journal of The Medical Sciences, 2020, 361(1): 43-54.
[7] GORGIEVAO S, TRCEK J. Bacterial cellulose: production, Modification and Perspectives in biomedical applications[J]. Nanomateriales, 2019,9(10): 1352.
[8] WANG J, TAVAKOLI J, TANG Y. producción de celulbacteriana, propiedades y aplicaciones con diferentes métodos de cultivo - una revisión [J]. Polímeros de carbohidratos, 2019, 219: 63-76.
[9] KHAN H, KADAMA, DUTT D. Studies on bacterial cellulose produced by a novel strain of Lactobacillus genus[J]. Carbohy- drate Polymers, 2020, 229(22) : 115513-115523.
[10] CHENG H, XU T. macrófagos polarización en el desarrollo y progresión de cánceres de ovari: una visión general [J]. Fron- tiers in Oncología,2019, 9: 421.
[11] RUFFELL B, COUSSENS L M. macrófagos y resistencia terapéutica en el cáncer [J]. Cancer Cell, 2015, 27(4): 462-472.
[12] BISWAS S K, MANTOVANI A. plasticidad de los macrófagos e interacción con subconjuntos de iymphocitos: el cáncer como paradigma [J]. Nature Immunology, 2010, 11(10): 889-896.
[13] CAO X, CHEN J, LI B, et al. Promover la fagocitosis celular dependiente de anticuerpos para inmunoterapia eficaz del cáncer basada en macrófagos [J]. Science Advances, 2022, 8(11): l91-201.
[14] WENG WH, GoelA. La curcumina y el cáncer colorrectal: una perspectiva actualizada y actual sobre esta medicina natural [J]. Sem- inars in Cancer Biology, 2022, 80: 73-86.
[15] TURCHI R, TORTOLICI F, Monica B, et al. Ami bajo en azufre - sin ácido, una dieta alta en ácidos grasos poliinsaturados inhiel crecimiento del cáncer de mama [J]. International Journal of Molecular Scien- CES, 2022, 24(1) : 249.
[16] LIM, GUO T, LIN J, et al. La curcumina inhila la invasión y metástasis de cáncer de mama triple negativo a través de Hedgehog/Gli 1 vía de señalización [J]. Journal of Ethnopharmacology, 2022, 283: 114689.
[17] WANG N Z, FENG T, LIU X N, et al. La curcumina inhila la migración and Invasión invasión of No pequeño cell lung cancer Células a través de la regulación de miR-206 y la supresión de la vía de señalización PI3K/ AKT/mTOR [J]. Acta farmacéutica, 2020, 70(3): 399-409.
[18] GHASEMI F, SHAFIEE M, ZARRIN S, et al. La curcumina in- hibits vías de NF-kB y Wnt/ p-catenina en células de cáncer de cuello uterino [J]. Investigación de la patología Y práctica, 2019, 215 (10): 152556.
[19] DA W, ZHANG J, ZHANG R, et al. La curcumina inhila la li-mphangiogé. of gastric cancer Células células by La inhibición Señalización HMGB1/VEGF-D [J]. International Journal of Im- munpathology logy and Pharmacology, 2019,33: 3107-3115.
[20] KHONCHE A, BIGLARIANO, PANAHIY, et al. Terapia adyuvcon curcumina para la úlcera péptica: un ensayo aleatoricontrol - led [J]. Drug Research, 2016, 66(8) : 444-448.
[21] JIANG C, LUO P. Nrf2/ARE es una vía clave para la curcumina - mediada Protección protección De la ATM condrocitos from Estrés oxidativo e inflamación [J]. Cell Stress and Chaperones, 2020, 25(3): 395-406.
[22] JIANG X, LI S, QIU X, et al. La curcumina inhila la viabilidad celular y aumenta la apoptosis de las células de adenocarcina - oma de colon humano SW620 vía la vía caudal Homeobox-2 (CDX2)/Wnt/ - catenina [J]. Monitor de ciencia médica: medicina internacional Journal of Experimental and Clínica clínica Research, 2019, 25: 7451-7458.
[23] KWIECIEN S, MAGIEROWSKI M, MAJKA J, et al. Curcu- min: un potente protector contra las enfermedades esofágicas y gástri[J]. International Journal ofMolecular Sciences, 2019, 20 (6): 1477.
[24] LATHAM A, SRINIVASAN P, KEMEL Y. la estabilidad del microsatélite se relaciona con la presencia del síndrome de Lynch en cáncer [J]. Revista de clínica Oncology, 2019, 37 (4): 286-295.
[25] LIU J, ZHANG J, REN L, et al. Partículas finas in- duce apoptosis vía ATM/P53/CDK2 y mitocondrias camino activado by oxidoxidoxidoxid El estrés o el estrés in rata Y GC-2spd cell[J]. Ecotoxicology and Environmental Safety, 2019, 180: 280-287.
[26] YU Y T, TIAN L Q, XIAO Y Y, et al. Efecto de la suplementación con vitamina D sobre algunos biomarcadores inflamatorios en sujetos con diabetes mellitus tipo 2: revisión sistemática y meta-análisis de ensayos controlados aleatorizados [J]. Anales de nutrición y metabolismo, 2018, 73(1): 62-73.
[27] NI Y, NI L, ZHU F, et al. Adipoyissue macrófagos pheno- tipos y características: la clave para la resistencia a la insulina en obesidad y trastornos metabólicos [J]. Obesidad, 2020, 28(2): 225-234.
[28] JEFFRY A, ANDREW M J, BODDY AV. Curcumin como un cli- nicnicprometeagente contra el cáncer: farmacocinética e interacciones con medicamentos [J]. Expert Opin on Metabolism and Toxicology, 2017, 13(9) : 953-972.
[29] ZHANG J L, ZHANG J, ZHANG R, et al. Implicaciones de los glomérulde de depósito im- munoglobulina G en pacientes chinos con nefropatía diabética [J]. Clinical and Experimental Pharma- cology and Physiology, 2020, 47(6) : 919-926.
[30] FENG J, LU S Y, OU B, et al. El papel de la señalización Pat - hway de JNK en la resistencia a la insulina impulsada por la obesidad [J]. Diabetes, síndrome metabólico y obesidad: objetivos y terapia, 2020, 13: 1399-1406.
[31] XIAO H, KANG S. The role of gut microbiome in Energy balance with a focus on The gut- adipoTejido tejido tejido tejido tejido tejido tejido tejido tejido tejido tejido tejido tejido tejidoaxis[J]. Fronti- ers in Genetics, 2020, 11(7): 297.
[32] HERSOUG L, MOLLER P, LOFT S. Role of microbiota-de- rived lipopolisacárido in adipo tissue Infflamación, tamaño de los adipocitos y piroptosis durante la obesidad [J]. Nutrition Re- search Reviews, 2018, 31(2): 153-163.
[33] RACHDAOUI N. insulina: el amigo y el enemigo en el desarrollo de la diabetes mellitus tipo 2 [J]. International Journal of Molecular Sciences, 2020, 21(5) : 1770.
[34] MOHAMAD A, VAHIDEH HZ. Las vías de señalización de la IL-6 y el desarrollo de la diabetes tipo 2 [J]. Inflflammopharmacology, 2018, 26(3) : 685-698.
[35] AKASH M SH, REHMAN K, Liaqat A. necrosis tumoral FAC - tor-alfa: papel en el desarrollo de resistencia a la insulina y Pat - hogénesis de diabetes mellitus tipo 2 [J]. Journal of Cellular Biochemistry, 2018, 119(1): 105-110.
[36] VOLPE C M O, VILLAR D, PAULA M, et al. Muerte celular, especies reactivas de oxígeno (ROS) y complicaciones diabéticas [J]. Muerte celular y enfermedad, 2018, 9(2): 119.
[37] WANG J, WANG H. estrés oxidativo en la regeneración de células beta pancre[J]. Medicina oxidy longecelular, 2017, 120(9): 193-201.
[38] HESARI AR, MITRA A, ALIREZA S, et al. Potencial quimioterapéutico y terapéutico de la curcumina en pacientes esofágicos: estado actual y futuro [J]. International Journal of Cancer, 2019, 114(6): 1215-1226.
[39] KARBALAEI M, TALEBI B. relevancia clínica del estado de CagA y VacA s1m1 y resistencia a antibióticos en Helicobac- ter pylori: una revisión sistemática y meta-análisis [J]. BMC In- fectious Diseases, 2022, 22(1): 573.
[40] COVER T L, LACY D B, OHI M D. El Helicobacter pylori cag tipo IV sistema de secreción [J]. Trends in Microbiology, 2020, 28(8): 682-695.
[41] UMAR B, ROUTHUN K, KUMAR A. roles multifacéticos de inhibidores de moléculas pequeñas derivados de plantas en el ciclo de replicación de SARS-CoV-2[J]. Microbiana ogénesis, 2022, 168: 105512.
[42] KARKHAN A. Helicobacter pylori estrategias de evasión de la respuesta inmune innata y adaptativa del huésped para sobrevivir y desarrollar enfermedades gastrointestinales [J]. Investigación microbiológica, 2018, 218: 49-57.
[43] MENTIS A, BOZIKI M, GRIGORIADISN. Helicobacter py — infección por Lori y cáncer gástrico biología: templar una célula de espada de doble filo [J]. Ciencias de la vida celular y Molecular, 2019, 76(13): 2477-2486.
[44] PEREIRA M J. Infección por Helicobacter Pylori, El microbioma gástrico y el cáncer gástrico [J]. Avances en medicina Experimental y biología, 2019, 1149: 195-210.
[45] TANG X Q, BIH, FENG J Q, et al. Efecto de la curcumina sobre la resistencia a los mul- tifármacos en el estómago humano resistente Carcinoma carcinoma carcinoma carcinoma carcinoma carcinoma carcinoma carcinoma Línea celular SGC7901/VCR[J]. Acta Pharmacologica Sinica, 2005, 26(8): 1009-1016.
[46] PIWOCKA K, BIELAK M A, EWA S. Curcumin induce cas- pase-3 independiente Apoptosis en humanos Células multirresistentes [J]. Anales de la Academia de ciencias de nueva York, 2002, 973: 250-254.
[47] PAL S, TANYA D, GAURISANKAR S. Curcumin induce selectivamente apoptosis en células sereguladas por ciclina D1 expresadas en la fase G2 del ciclo celular de una manera dependiente de p53 [J]. Journal of Biological Chemistry, 2005, 280(20): 20059-20068.
[48] CHEN Y, KUO T C. inducde la expresión génica de HSP70 por modulación del Ion Ca(12) Y proteína celular p53 por curcu- min en células de carcinoma colorrectal [J]. Carcinógeno Molecular - ESIS, 1996, 17(4) : 224-234.
[49] KATO K, ITO H, KAMEI K, et al. Estimulación de la wxpression indupor estrés de proteínas de estrés por la curcumina en células cultivadas y en tejidos de rata in vivo[J]. Cell Stress and Chaperones, 1998, 3(3) : 152-160.
[50] SUNDAR D K S, HOURELD N N, MHEIDI A, et al. Thera- potencial terapéutico y avances recientes de la curcumina en el tratamiento de enfermedades asociadas al envejecimiento [J]. Moléculas, 2018, 23(4): 835.
-
anterior
¿Cuál es la emulsificación y encapsulación de polvo de curcumina?
-
siguiente
¿Es la cúrcuma buena para el riñón?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés



