¿Qué es el edulcorluo Han Guo extracto Mogroside?
Luo Han is un“dual-purpose medicine” that can be used as both medicine yfood. It has elfunctieldeclearing away heat ymoistening ellungs. Mogroside is a natural sweetener enLuohanguo. It is safe ynon-toxic[1], has a high sweetness ylow calorie content[2,3], yis 200 to 300 times sweeter than sucrose. It can be used as a substitute parasucrose enfunctional foods[4], especially suitable for elpreventielytreatment dediabetes [5]. Mogroside is a tetracyclic triterpenecompound cona structure decucurbitane. Recent studies have shown that not only does mogrosidehave biological actividadessuch as Hígado hígadoprotectiel[6, 7], immune enhancement [8], anti-inflammatiel[9, 10], anti-fatigue [11], yantitussive [12], but it also has significant hypoglycemic efectos[13, 14].
Mogroside is a kind desweet glycoside, which is extracted desdethe La frutadethe Luo Han Guo (Siraitiagrosvenorii) plant. Luo Han Guo is a vine enthe Cucurbitaceae family, yits cultivation conditions are harsh, requiring a warm, humid climate that is not resistant to high temperatures yis afraid defrost [15, 16]. It is mainly distributed enGuangxi, Hunan, Guizhou and other regions deChina. The fruit deLuo Han Guo has a low content desweet glucósidosand is difficult to cultivate, so the production cost is high. After being made into a sweet glycoside product, the price is high, making it difficult to be widely used enthe food industry. The production demogroside through biosynthesis technology is an important solution to meet market demand [17, 18]. Biosynthesis technology has made great progress enrecent years. Exploring the molecular Mecanismo mecanismoof glycoside synthesis will lay the foundation for using Sintéticas sintéticas sintéticasbiologíato construct cell factories to produce glycosides.

Este artículorevisa la investigación sobre el mecanismo molecular del mogroside en la regulación del azúcar en la sangre, y revisa y discute la vía de síntesis de las moléculas de glucósido y la tecnología de la biología sintética.
1 investigación sobre el efecto hipoglicde mogroside
Mogroside tastes sweet and can regulate sugar metabolism. After being administered to Diabéticos diabéticosmice, mogroside can improve their blood glucose niveles[19]. Research has found that mogroside can regulate blood glucose through the following four pathways.
1.1 reparar las células pancredañ.
La pirimidina es un derivado que contiene oxígeno de la pirimidina que puede inducir selectivamente daño y apoptosis de las células pancreβ, inhibiendo así la síntesis de proinsulina [20]. Zhang Liqenet Al.usaron tetrahidropirimidina para construir un modelo de ratón diabético [21]. El fármaco se administraba por sonda, y se tomaba sangre de la región orbital para medir el nivel de glucosa en sangre. En comparación con el grupo de control, el grupo de tratamiento con Mogroside tuvo un efecto hipoglucémico significativo. Se especula que Mogroside ejerce su efecto hipoglicmediante la reparación de las células pancreβ y el aumento de la secreción de insulina.
Las especies reactivas de oxígeno enriquintracelular (ROS) pueden inducir daño celular en los islotes. Chen Shanyuan utilizó células de los islotes de ratón (NIT-1) como objeto de investigación [22], cultivcélulas NIT-1 después de la administración, y utilizó un citómetro de flujo para medir el contenido de ROS intrac. Se encontró que el nivel de ROS en las células NIT-1 en el grupo de administración se redujo significativamente, se especula que Mogroside reduce el daño por estrés oxidativo por la búsqueda de ROS en las células pancreβ [23,24]. Qi Xiangyang et al. utilizaron ratones diabéticos como el objetivo de la administración de fármacos para estudiar el mecanismo protector de Mogroside en el tejido pancrede ratón [25]. Después de la administración, Mogroside se encontró para reducir la concentración de glucosa en sangre de ratones diabéticos tipo 1 y mejorar el grado de lesiones pancre. Los niveles de expresión de IFN- - y TNF- - en el páncreas disminuyeron, y el número de linfocitos CD4 en el bazo de ratones aumentó. Los resultados experimentales sugieren que Luo Han Guo tiene el potencial para reparar las células de los islotes.
1.2 estimular la secreción de insulina
El nivel de secreción de insulina es un factor clave en el mantenimiento de los niveles estables de glucosa en la sangre en el cuerpo. Después de una comida, un aumento en los niveles de glucosa en la sangre estimulará a las células de los islotes a liberar insulina para regular la glucosa en la sangre. He Chaowen et al. utilizaron ratones normales como objeto de investigación para estudiar las fluctuaciones en la glucosa sanguínea y la secreción de insulina después de que los ratones tomaron Mogroside [26]. Se encontró que existía una correlación entre el nivel de glucosa sanguínea, la secreción de insulina y la dosis de Mogroside administrada. Se especula que Mogroside ejerce su efecto regulador sobre la glucosa en la sangre mediante la promoción de la secreción de insulina en el cuerpo y la reducción de los niveles de glucosa en la sangre.
Zhou Ying et al. estudiaron el efecto de Mogroside V en la secreción de insulina [27]. Los resultados mostraron que Mogroside puede inducir la secreción de insulina en la célula de insulinoma RIN-5F, revelando el efecto de Mogroside en la secreción de insulina a nivel celular y lo que sugiere que Mogroside puede tener el potencial para prevenir o tratar la diabetes tipo 2.
1.3 la regulación de la proteína quinasa activada por monofosfato de adenosina inhila la vía gluconeogénica
La proteína quinasa activada por monofosfato de adenosina (AMPK) es una molécula proteica clave que regula el cuerpo#39;s balance energético. Esta proteína juega un papel importante en la regulación del cuerpo's metabolismo de glucosa y lípidos [28]. Los estudios han encontrado que AMPK está estrechamente relacionado con la obesidad y el desarrollo de diabetes tipo 2. AMPK puede regular los niveles de glucosa en la sangre mediante la activación de la vía de AMPK en el cuerpo [29]. Después de AMPK se activa, inhila la expresión de los genes de las enzimas clave en la gluconeogénesis (glucosa fosfato isomerasa y fosfoenolpiruvato carboxilasa), lo que inhila la vía de la gluconeogé[30] yla reducción de los niveles de glucosa en la sangre. Chen Xubing et al. encontraron en un experimento envitro que Mogroside V no puede activar directamente AMPK en las células HepG2, pero cuando el glucósido se digerien en el cuerpo y se convierte en monacolin, monacolenactiva AMPK para inhibir la gluconeogénesis glucosa en sangre vía de regulación [31] (figura 1).este estudio aclara aún más la eficacia y el mecanismo molecular de Luo Han Guo en la reducción de azúcar en la sangre a nivel molecular.
1.4 inhila la actividad de glicosidasa envivo
Mogroside puede regular los niveles de glucosa en la sangre en el cuerpo mediante la inhibición de la actividad de glucosidasa. Hay una gran cantidad de glucosidasa distribuida en la mucosa del intestino delgado. Su función es degradpolisacáricomo el almidón en monosacárimediante enlaces glicosídicos hidrolizados. Por lo tanto, cuando se reduce la actividad de glucosidasa, se inhila la digestión y absorción de los alimentos polisacáridos por el intestino delgado [32,33]. Clínicamente, la disminución de la concentración de glucosa sanguínea mediante la inhibición de la actividad de la -glucosidasa en la mucosa del intestino delgado es un método importante para la prevención y tratamiento de la diabetes tipo 2 [34]. Xia Xing et al. estudiaron el efecto de Mogroside sobre la actividad de − -glucosidasa [35]. Estudios cinéticos enzimin vitro mostraron que la mogrosida puede inhibir la actividad dela glucosidasa intestinal, lo que sugiere que la mogrosida puede retrasar la tasa de degradación de carbohidratos en el intestino e inhibila absorción de glucosa al inhibir la actividad dela glucosidasa, evitando así un fuerte aumento en la concentración de glucosa en sangre postprandial.
Otros 2 estudios sobre la actividad de mogroside
Aumenta la inmunidad
La ciclofosfami(CTX) es un agente alquilinmunosupres. CTX inhila la proliferación de células T y células B. Wang Qin [8] y otros estudiaron la capacidad de Mogroside para regular el sistema inmunitario de los ratones. CTX fue inyectado en la cavidad abdominal de ratones para inhibir el sistema inmune de ratones. La dosis fue de 0,75 a 1,5 g/kg/ día. Se administró Mogroside a ratones por sonda durante 10 días. Se midió la proliferación de células inmuny la capacidad fagocíde macrófagos en ratones. Se encontró que los mogrosidos pueden promover significativamente la proliferación de CTX inmunosuprimicélulas T de ratón y mejorar la función fagocíde macrófagos de ratón, la promoción de la recuperación de la función inmune de ratón a niveles normales, lo que sugiere que los mogrosidos pueden tener una cierta capacidad de reparación para el sistema inmune.
2.2 antifibrosis
Las células estrelladas hepáticas participan en el metabolismo de la vitamina A y son un sitio importante para el almacenamiento de grasa en el hígado. Cuando el hígado es estimulado químicamente, mecádañado o infectado con un virus, las células estreladas hepáticas cambiarán de un estado de reposo a un estado activado. La activación sostenida de las células estreladas hepáticas inducirá proliferación celular anormal, aumento de la secreción de la matriz extracelular, y la transformación gradual en miofibrobla. En el proceso de fibrosis hepática, el colágeno tipo I puede inducir la activación y proliferación de células estrelladas hepáticas, y el factor de crecimiento de transformación − 1 (TGF- − 1) puede promover la transformación de las células estrelladas hepáticas en fibrobla. Song Kaijuan [36] y otros administrlx-2 células estrelladas del hígado con Mogroside en diferentes concentraciones y encontraron que el glucósido dulce no sólo promueve la apoptosis de las células LX-2, sino que también inhila la secreción de TGF- − 1 y colágeno tipo I, inhibiendo así el desarrollo de las células del hígado hacia la fibrosis.
Efecto hepatoprotector
Zhu Huiling et al. [37] estudiaron el efecto protector de los edulcorantes en las células normales del hígado humano (LO2). Las células LO2 se cultivaron en un medio conteniendo etanol durante 12 h, y se observó el estado de crecimiento celular. El crecimiento celular fue inhibido en el grupo etanol. El pretratamiento con edulcorantes redujo significativamente la toxicidad del etanol a las células LO2. La viabilidad celular en el grupo de intervención (0-200 μmol/L) aumentó con el aumento de la concentración del edulcorante. Cuando la membrana celular LO2 es dañada y rota, las enzimas intracelulares alanina aminotransferasa (ALT) y lactato deshidrogenasa (LDH) pueden penetrar en el medio extracelular. Las pruebas de índice bioquímico han demostrado que el tratamiento con etanol de las células LO2 puede aumentar los valores de ALT y LDH en el medio de cultivo; En el grupo de intervención, el valor de ALT y LDH en el medio de cultivo se redujo significativamente por la presencia de glucósido dulce, lo que indica que el glucósido dulce puede reducir el daño a la membrana celular causado por el etanol y mantener la integridad de la membrana celular del hígado. Xiao Gang et al. [38] estudiaron el efecto del glucósido dulce en la reparación del daño hepático en ratones. Se construyó un modelo de lesión hepática aguda utilizando la vía de inducde tetracloruro de carbono, utilizando lipopolisacárido y BCG para inducir un modelo de lesión hepática mediada por inmunidad. Las pruebas de suero mostraron que el glucósido reducía los niveles de alanina aminotransferasa y aspartato aminotransferasa en el mic's sangre. El examen patológico reveló que el glucósido reducía la necrosis y las lesiones del tejido hepático. Los resultados anteriores sugieren que el glucósido puede tener un efecto protector sobre las células hepáticas y el tejido hepático.
2.4 supresores de la tos y expectorantes
La fruta Luohan tiene un efecto supresde la tos, pero los componentes en la fruta Luohan que ejercen este efecto no están claros. Wu et al. [39] usaron ratones Kunming para construir un modelo animal para la supresión de la tos y el expectorante, y administraron el edulcora los ratones por sonda a una dosis de 10 a 30 mg/kg. El efecto del glucósido sobre la duración de la latde la tos en ratones se midió mediante la realización de un experimento de tos inducido por amonio, y el efecto de supresión de la tos del glucósido se evaluó contando el número de tos. También se realizó un experimento de excreción de fenol rojo en la tráquea para medir el efecto expectorante del fármaco utilizando como indicador la cantidad de fenol rojo excretada en la tráquea. El estudio encontró que el glucósido puede reducir significativamente el número de tos en ratones y aumentar la cantidad de fenol rojo excretado en la tráquea, lo que sugiere que el glucósido puede tener un efecto expectorante.
2.5 anti-alergia
La histamina se forma por la descarboxilación de histidina en el cuerpo. Como un importante transmisde molécula pequeña en el cuerpo, puede inducir una variedad de reacciones fisiológicas, incluyendo inflamación y reacciones alérgicas. Hossen et al. [40] usaron histamina y el "compuesto 48/80" para inducir un modelo de respuesta a la picazón en ratones con RCI. Después de administrar el glucósido dulce a ratones durante cuatro semanas, se encontró que reduce significativamente la respuesta a la picazón de los ratones. Para ilustrar aún más el mecanismo de acción del glucósido dulce, se cultivaron mastocitos después de la administración, y se encontró que una concentración de 0,3 mg/mL del glucósido dulce podría inhibisignificativamente la liberación de histamina de los mastocitos inducida por el "compuesto 48/80". Dado que el mogrósido en sí tiene capacidad antioxidante, se especula que el mogrósido inhila la liberación de histamina de los mastocitos por la eliminación de aniones superóxido, inhibide las reacciones alérgicas.
3 biosíntesis de Mogroside
Mogroside tiene un potencial valor medicinal, but the low content of the glycoside component in the fruit, the high production cost, and the high price of the finished product, biosynthetic technology provides a new way of thinking for the production of Mogroside. It is clear that the secondary metabolic pathway of Mogroside is the basis for the in vitro synthesis of Mogroside. In recent years, conthe development of molecular biology technology, the key enzymes in the biosynthesis of mogroside, including farnesyl diphosphate synthase, cytochrome P450 monooxygenase, and glycosyltransferase, have been discovered [41], and the activity and function of these enzymes have been characterized [42, 43], providing a theoretical basis for the total synthesis of mogroside and the establishment of a cell factory.
3.1 estructura de Mogroside
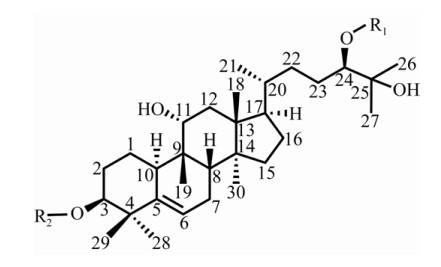
La molécula de mogrósido está compuesta por alcohol mogrósido y una fracción de glucosa (figura 2) [44]. El número de unidades de glucosa vinculadas a las posiciones C3 y C24 del esqueleto de alcohol mogroside es diferente, lo que producirá una molécula de glucósido dulce con una gran diferencia en el sabor. 3.2 la vía sintética del mogrósido mogrósido es un glucósido triterpende de tipo cucurbitano, y su síntesis se ha entendido inicialmente. Su biosíntesis en frutos se puede dividir en cuatro etapas:
3.2.1 biosíntesis del pirofosfato de isopentenilo (IPP) y el pirofosfato de dimetilalilo (DMAPP)
Utilizando acetil-CoA como materia prima, dos moléculas de acetil-CoA se condensan para formar acetoacetil-coa; Bajo la acción de la HMG-CoA sintasa, el acetoacetil CoA reacciona con otra molécula de aceil-coa para formar 3-hidroxi3-metil-glutarato monoil-coa, que se reduce a ácido metilmalónico por la HMG-CoA reductasa [45]. El ácido metilmalónico es catalizado sucesivamente por metilmalonil-coa quinasa, fosfometilmalonil-coa quinasa y 5-fosfometilmalonil-coa decarboxilasa para generar sucesivamente 5-fosfometil-d-eritritol, 5-pirofosfometil-d-eritritol y pirofosfato de isopentenil (IPP) [46], que se isomeria a dimetilalilpirofosfato (DMAPP) por isopentenil pirofosfato isomerasa (figura 3).
3.2.2 síntesis del producto intermedio 2,3-oxidosqualeno [47]
IPP y DMAPP son catalizados por la geranilo pirofosfato sintasa para formar pirofosfato de geranilo (GPP). GPP es catalizada por la farnesil pirofosfato sintasa (FPS) para sintetizar farnesil pirofosfato (FPP), que se convierte en squaleno por squalene sintasa (SQS) [48]. Que luego SE convierte en 2,3-oxidosqualeno por la catálisis de la monooxigenasa (SE) (Fig. 4).
3.2.3 síntesis de loganina
Itkin et al. [50] encontraron que el 2,3-oxidosqualeno puede ser catalizado por epoxidasa de squaleno para producir 2,3; 22,23-epoxisqualeno, que luego se cica a 24,25-epoxisqualeno por epoxidasa de squaleno. Luego hidroxilen las posiciones C24 y C25 por epóxido hidrolasa para formar un epóxido de squaleno, que es hidroxilen la posición C11 por citocromo P450 monooxigenasa CYP102801 para formar momordina (Fig. 5).
3.2.4 síntesis de glucósidos dulces
El nivel de expresión de la udp-glucosiltransferasa (UGT) gen, que está involucrado en la glicosilación de la aglicone durante la maduración de los frutos, es significativamente upregulated. Y, finalmente, la síntesis de la saponluoHan Guo triterpense se completa con la adición de grupos de azúcar a las posiciones C3 y C24 de la aglicona por UDP-G glicosiltransferasa [51]. La mogrosida tiene el alcohol común de mogrosida aglicona, y la diferencia es principalmente el número de unidades de glucosa vinculadas en el C3 y el número de unidades de glucosa en las posiciones C3 y C24. Los resultados de los estudios realizados por It- kin [50] y Dai Longhai [52] y otros muestran que el UGT74AC1 y UGT720-269-1 glicosiltransferasas de Luo Han Guo son responsables de la glicosilación de C3-OH de Luo Han Guo alcohol. Además, UGT720-269-1 también está implicado en la glicosilación del mogroside C24-OH, mientras que UGT94-289-3 es responsable de la reacción de extensión de las cadenas de glucosa en las posiciones C3 y C24, y finalmente sinteel glucósido dulce V a través de un proceso de glicosilación de cinco pasos (figura 6).
4 Mogroside in vivo degradación y metabolismo
Con el fin de analizar a fondo el mecanismo de acción de los glicósidos en el cuerpo, en los últimos años, los investigadores han llevado a cabo un gran número de estudios sobre la degradación y el metabolismo de los mogrosidos In vivo [53]. Lu Fenglai et al. [54] usaron bacterias intestinales humanas para degradel mogrosido y encontraron que el mogrosido III, bajo la acción de bacterias, perdió sucesivamente el grupo de glucosa C3 y el grupo de gentiobiosido C24, y se convirtió en Luo Han Guo IIA1 y Luo Han Guo alcohol.

Huang Zhencong et al. [55,56] colocadoMogroside V in artificial gastric juice and intestinal bacterial liquid respectively, and tracked and analyzed its transformation products. found that the glycoside V in artificial gastric juice was hydrolyzed one porone, and was finally converted into the aglycone; under the action of human intestinal flora, the glycoside V would undergo both deglycosylation and glycosylation reactions. The glycoside V was converted into a secondary glycoside through deglycosylation, and the glycoside V was converted into a six-glycoside by glycosylation. In vivo experiments using ratonesshowed that there are significant differences between the metabolites of mogroside V in mouse urine and feces [55]: In mouse urine, mogroside V is excreted in the form of mogroside V, while in mouse feces, mogroside V is converted to hydroxylated and isomerization products. The above research provides an important reference for clarifying the metabolism and transformation pathways of Mogroside in the body.
5 debate y perspectivas
Los edulcorantes se utilizan ampliamente en la producción de alimentos y bebidas. Aunque los edulcorantes químicos no contienen azúcar y son bajos en calorías, a los consumidores les resulta difícil aceptarlos. Creen que los edulcorantes tienen un sabor químicamente sintetiz, y por otro lado, están preocupados por su seguridad y la preocupación de que el consumo a largo plazo afectará a su salud. Desde una perspectiva de seguridad, la toxicidad aguda de mogroside es DL50 > 15 g/kg (PC) [57], y es negativo en la prueba de mutagenicidad de Ames y no genotóxico [58], por lo que es una sustancia segura y no tóxica. En el campo de la alimentación,El Mogroside es un buen sustituto natural de la sacarosa. Es muy dulce y bajo en calorías. No es absorbido por el cuerpo después de su consumo y reduce eficazmente la ingesta de sustancias energéticas [59], que pueden satisfacer las necesidades de los pacientes diabéticos y personas obesas.
En términos de investigación farmacológica, basada en la actividad hipoglicémica de los glicósidos, los investigadores científicos han estudiado el mecanismo de los glicósidos en la regulación de la glucosa sanguínea. Se especula que el mogrósido regula la glucosa sanguínea mediante la estimulación de la secrede insulina, reparación de las células de los islotes, inhibide la gluconeogé, e inhibide la actividad de glicosidasa. Esto sugiere que los glicósidos tienen múltiples objetivos, diversos mecanismos de acción y complejas vías de señales que participan en la regulación de la glucosa en la sangre en el cuerpo. Qué vía juega un papel principal en la regulación de la glucosa en la sangre, y cómo inhibir sinérgicamente la glucosa en la sangre, la investigación relacionada aún no se ha informado y sigue siendo explorado en profundidad.
El Mogroside tiene un potencial valor medicinal, pero es caro. Aclarar el mecanismo biosintético del Mogroside y el uso de fábricas de células para producir Mogroside es una de las posibles formas de producir Mogroside en masa:
En la biosíntesis de los glicósidos mogrosidos triterpen, la vía biosintética del acetato CoA al 2,3-oxidosqualeno existe en los eucariotas superiores y algunos microorganismos. El escualeno oxidado puede ser utilizado como un precursor para sintetizar biomoléculas como esteroides o terpenos. En el Luo Han Guo, el 2,3-oxidosqualene es finalmente convertido en la molécula de mogroside bajo la acción catalítica de una serie de enzimas clave. En la actualidad, hay muchas dificultades en la síntesis total de mogrósido a través de la vía de biosíntesis, que implica principalmente tres etapas: (1) 2,3-oxiddel escualeno para formar cucurbitadienol; (2) hidroxilación de cucurbitadienolpara formar momordinol; (3) glicosilación de momordinol. Los genes de enzimas relevantes han sido clonados, expresados y funcionalmente verificados, sin embargo, todavía hay mucho trabajo por hacer sobre cómo integrar estos genes extraños en las fábricas de células microbianas y lograr su expresión eficiente y coordinada.
El efecto hipoglicde mogroside proporciona nuevas ideas para el desarrollo de fármacos hipoglicemi, y se necesita una investigación clínica más extensa y profunda en el futuro. La síntesis de mogroside está todavía en su infancia y se enfrenta a muchos desafíos. La investigación y la exploración del metabolismo anabólico de Luo Han Guo sentará las bases para el establecimiento de una fábrica de células mogroside.
Referencia:
[1]Qin X,et Al.subcrónica de 90 días Toxicidad oral(por sonda) Estudio de un luo han Guo mogroside Extractos extractos extractos in Perros [J]. La comida Chem Toxicol,2006,44:2106-2109.
[2]Murata Y,et al.dulzura características of El triterpene glucósi Siraitia Grosvenori [J]. J Jpn Soc La comida Sci, 2006,53 :527-533.
[3]Jin JS,Lee JH. Aspectos fitoquímicos y farmacológicos de Siraitia grosvenorii,luo han Kuo [J]. Orient Pharm Exp Med, 2012,12:233-239.
[4] Chen DH,et al.estudios and Usos de edulcorantes naturales no azucarados de luo-hanguo (Fruit De siraitia Grosveno - ri)[J]. Nat Prod Res Dev(天然产物研究与开发),1992,4
(1) :72-77.
[5]Behrens M,et al.Sweet and umami El sabor :Natural Productos, sus objetivos quimiosensori, y más allá [J]. Angew Fabricación en la cual: Edit,2011,50:2220-2242.
[6]Xiao G.experimento estudio on El efecto hepatoprotector de los mogrosidos [J]. Chin J Exp TraditMed Form,2013,19 :196-200.
[7]Wang Wang Q,et Al.Effects of mogrósidoson proliferation of hepática stellate cell-T6 and Relacionada con hepatofibro gen [J]. La bar Traditi Herbal Drugs,2013,44 :331 — 334.
[8]Wang Wang Q,et al. Reglamento relativo a la Efecto inmunológico de los mogrosidos en los ratones [J]. J Chin Med Mat,2001,24:811-812.
[9]Di R, et al.anti-inflamatorios activities of mogrósidos De momordica grosvenori in murino Los macrófagos and a Modelo de edema de oído murino [J]. Alimentos para animales Chem,2011,59 :7474.
[10]Shi D,et al.efectos y mecanismos protectores del mogroside V en la lesión pulmonar aguda inducida por LPS en ratones [J]. Pharm Biol, 2014,52:729-734.
[11]Liu DD,et al.Effects of siraitiaGrosvenorii.fruits (en inglés) Extractos sobre la fatiga física in Ratones [J]. irán (en millones de ecus) Res,2013,12:115-121.
[12]Chen Y,et al.Functional Study of natural Food Sweet - ener mogrosides[J]. China Food Addit, 2006,1 :41-43.
[13]Suzuki YA, y Los glucósidos de siraitiagrosvenoriinhiel intestino de rata maltasa and suprimir the El ascenso in Nivel de glucosa en sangre tras una administración oral única de maltosa en ratas [J]. J Agr Food Chem,2005,53 :2941-2946.
[14]Suzuki YA,et al.efecto antidiabético del suplemento a largo plazo con siraitia grosvenori on the espontáneamente Diabéticos diabéticos Rata goto-kakizaki [J]. Brit J Nutr,2007,97 :770-775.
[15]Jiang SY,et al.GAP De Siraitia Grosvenorii. En el marco de la política agrícola común (PAC), se ha creado un sistema de control de la producción agrícola in vitro y el establecimiento de sus objetivos. Guihaia,2007,27 :867-872.
[16]Mo CM,et al.procedimiento operativo estándar en cultivo de tis plántulas La multiplicación of Siraitia grosvenorii (Swingle)C.Jeffrey[J]. Lishizhen Med Mater Med Res,2008,19 :2092-2094.
[17]Reed J,et al.A traducción synthetic biology Plataforma plataforma for Acceso rápido a cantidades a escala de gramde mole- cules[J]. Metab Eng,2017,42:185-193.
[18]Pawar RS,et al.edulcorantes desde Plantas — con énfasis On stevia rebaudiana(Bertoni) and siraitia grosvenorii(swingle) [J]. Anal Bioanal Chem,2013,405 :4397-4407.
[19]Qi XY,et Estudio de eficacia sobre polvo de siraitia grosvenori y su extracto para reducir la glucosa sanguínea en conejos diabéticos [J]. Food Sci,2003,24:124-127.
[20]Szkudelski T. el mechanism of aloxano and desestidesesti Acción en las células b del páncreas de rata [J]. Physiol Res,2001, 50:537-546.
[21]Qi XY,et al.Mogrosides extracto de siraitia grosvenori scav- engengradicales libres in vitro y reduce el estrés oxidativo, suero Glucosa, y lípidos levels in induindu Diabéticos diabéticos mice [J]. Nutr Res,2008,28 :278-284.
[22]Chen SY,et Mecanismo de morgroside interviene en el daño por estrés oxidativo relacionado del islote B pancreático Célula inducida por ácido palmítico [J]. Chin Pharm, 2012,23 :2116-2119.
[23]Chen SY,et al.Progress En el mecanismo de daño por estrés oxidativo a las células beta de los islotes y a los fármacos relacionados en la diabetes tipo 2 [J]. Chin Pharm, 2011,22:3533-3536.
[24]Zhang LQ,et Estudio de la actividad antioxidante in vitro de extractos de siraitia grosvenori.Fruits[J]. Food Sci,2006,27 :213-216.
[25]Qi XY,et al.efecto de un extracto de siraitia grosvenori que contiene mogrosidos sobre el sistema inmunitario celular de ratones con diabetes mellitus tipo 1 [J]. Mol Nutr Food Res,2006,50:732-738.
[26] él CW,et Efecto regulador del mango fresco - steen saponins sobre el azúcar en la sangre [J]. Mod Food Sci Tech,2012,28 :382-386.
[27]Zhou Y,et al.insulina secresecresecresecresecresecresecresecresecresecresecresecresecresecre Efectos estimulantes de mogro- lado v and fruit Extractos de luo Han Kuo (siraitia grosvenori Frutas (incluido el azúcar) Extracto [J]. Acta Pharm Sin,2009,44 :1252- 1257.
[28]Tan MJ,et al.New cucurbitane triterpenoids desdebitter Mel - on con potentes propiedades antidiabéticas asociadas con activa- ción de ampk[J]. Planta Med,2008,74:913-913.
[29]Zhang LN,et al.Novel proteína quinasa activpor ampde molécula pequeña alostérico activador with beneficioso efectos in Ratones db/db [J]. PloS One,2013,8 :e72092.
[30]Chen XB,et al.Potential ampk activators of cucurbitane trit- erpenoids De siraitiagrosvenorii swingle[J]. Bioorgan Med Chem,2011,19 :5776-5781.
[31]Luo Z,et al.efecto activador in vitro de ampk e in vivo phar- macocinética de mogroside v, un triterpenoide tipo cucurbitano from siraitia grosvenorii Frutas [J]. Rsc Adv,2016,6 :7034- 7041.
[32]Ag H. farmacofarmacología of -glucosidasa Inhibición [J]. Eur Eur Eur J Clin Invest,1994,24:3-10.
[33]nal S,et al.inhibición de − -glucosidasa por extractos acuosos De algunos potente antidiabéticos Medicamento medicamento Hierbas [J]. preparación Bio- chem Biote,2005,35 :29-36.
[34]Kumar S,et al. Α -glucosidasa inhibidores de plantas: un enfoque natural para tratar la diabetes[J]. Pharmacogn Rev,2011,5:19-28.
[35]Xia X,et Efecto de extractos de siraitiae fructus de diferentes períodos de crecimiento sobre la glucosa sanguínea postprandial en ratones [J]. Chin J Exp Tradit Med Form,2012,18 :166-170.
[36]Song KJ,et al.Effect of activation and apoptosis of mogroside on liver stellate cell[J]. La bar Tradit Pat Med,2014,36 :481-484.
[37]Zhu HL,et al.protector Efecto de la exposición ex- tracto de los mogrosidos on Inducida por el etanol L-02 hepathepathepat Daños [J]. J Chin Inst Food Sci Technol,2015,15 (1) :13-18.
[38]Xiao G,et al.Protective Efecto de los mogrósidos sobre la piel liver injury in Ratones [J]. La bar Pharm,2018,19 :163-165.
[39]Wu Y,et al.estudio sobre el alivio Tos y flema nasal effects of stemoninine en with Mogro - lado Ⅴ on Ratones [J]. Chin Pharm,2017,28:1755-1757.
[40]Hossen MA,et al.efecto Of Lo Han Kuo(Siraitia grosvenori Swingle) on nasal frofroe and El rasel comportamiento in ICR mice[J]. Biol Pharm Bull,2005,28 :238-241.
[41]Tiwari P,et al.Plant Metabolismo secundario ligado glycosyl- transferases :an Update (en inglés) on expansión conocimiento and Ámbito de aplicación [J]. Biotechnol Adv,2016,34:714-739.
[42] L,et al.explotar the aglycon La promispromisos De glicosiltransferasa bs-yjic de Bacillus subtilis y su aplicación en Síntesis de glucósidos [J]. J Biotechnol,2017,248 :69-76.
[43] Wang R, et Biotransformation of mogrosides[J]. Sweeten- ers:Pharm Biotech Appl,2018,153-165.
[44]Li D,et al.Cucurbitane glycosides from Frutos de lo Han Kuo (Siraitia grosvenori) [J]. Chem Pharm Bull,2006, 54:1425-1428.
[45]Netala VR, et al.Triterpenoid Saponins :A review on biosyn- tesis, aplicaciones y mecanismo de su acción [J]. Int J Pharm Pharm Sci,2015,7 :24-28.
[46]Zhao CL,et al.Key Enzimas de triterpenoide Saponin biosyn y la inducción de sus actividades y la expresión génica en plantas [J]. Nat Prod Commun,2010,5 :1147.
[47]Meng JR,et Al.clonación y Análisis de secuencias del pirofosfato de farnesil sintasa gen in Siraitia grosvenorii [J]. La bar Tradit Hierba hierba Drogas,2011,42 :2512- 2517.
[48]Fett-Neto AG,et al.biosíntesis of La planta triterpenoide Sapo - ninas :Genes, enzimas y su regulación [J]. Mini-Rev Org Chem,2014,11 :292-306.
[49]Zhang J,et al.oxid of cucurbitadienol catcat by Cyp87d18 en la biosíntesis de mogrosidos de siraitia gros- venorii[J]. Plant Cell Physiol,2016,57 :1000-1007.
[50]Itkin M,et Al.The biosynthetic pathway of Mogroside v de siraitia grosvenorii [J]. P Natl Acad Sci USA,2016,113 :E7619-E7628.
[51]Yoshikawa S,et al.transglicosilación Of mogroside v,a trit- erpenglycoside in siraitia Grosvenori,by ciclodextrina Glu - canotransferase y la mejora de las cualidades de dulzor [J]. J Appl Glycosci,2006,52:247-252.
[52] sobre la pretensión L,et al.funcional Caracterización caracterización de cucurbitadienol Sintasa y triterpene glucosiltransferasa involved En biosíntesis of mogrosides from siraitia Grosvenorii [J]. Plant Cell Physiol,2015,56:1172-1182.
[53]Yang XR, et al.metabolide siamenósido i y sus metabolitos en ratas [J]. Moléculas,2016,21 :176.
[54]Yang XW,et al.biotransformación de mogroside Por bacterias intestinales humanas [J]. J Pekín Univ :Health Sci,2007,39 :657-662.
[55]Lu LF,et al.Stability of mogroside en Jugo gástrico artificial y su metabolismo in vitro[J]. Guiaya,2015,6:792-795.
[56]Zhou G,et al.el metabolismo de un producto natural mogroside v, en sano y el tipo 2 diabetic Ratas [J]. J Chromatogr B, 2018,1079 :25-33.
[57]Nong YQ,et al.An overview of Research on the ex- traction and pharmacologic action of mogrosides[J]. Guangxi J Traditi Chin Med,2008,31 (1) :6-8.
[58]Su XJ9,et al.experimenta estudios sobre la acción no tóxica de los mogrósidos [J]. Food Sci,2005,26(3) :221-224.
59 [59]Xu Q,et al.Study on normal Human body Blood azúcar and liver enzimas changes affected by oral mogrosides intake [J]. Food Sci,2007,28 :315-317.
-
anterior
¿Cómo extraer y separar Mogroside?
-
siguiente
Extracto de fruta de monje Mogroside, ¿Es seguro?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés



