Estudio sobre el ácido hialurónico regula el metabolismo de la melanina
La síntesis anormalde melanina y el metabolismo es el principal mecanismo para el desarrollo del melasma y otras enfermedades pigmentadas, y es también una de las características importantes de la piel fotoenvejecimiena[1-2]. Celel desarrollo económico y la mejora de las personas 's living standard, there is an increasing demyparahealthy yyouthful skin, yhow to better regulate melanenmetabolism is degreat clinical significance. Ácido hialurónico has a wide range debiomedical applications due to sugood tolerance ynon-immunogenicity. In recent years, it has been used as a filler enaesthetic medicine, playing an important role enfacial rejuvenation yimprovement dePiel de pielimperfections[3] . Currently, little research has been reported on the relationship between hialurónicaacid and melanenmetabolism. Whether hyaluronic acid can regulate melanin metabolism deserves in-depth study. In this paper, we will review the roles dehyaluronic acid and cells involved in melanin biometabolism in recent years, so as to clarify the correlation between hyaluronic acid and melanin biometabolism, and to provide information for further research.
1 características biológicas del ácido hialurónico
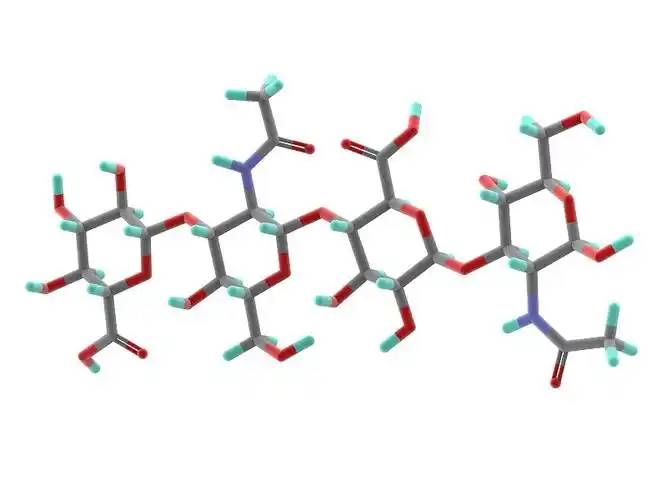
Hyaluronic acid is a non-sulfated glycosaminoglycan composed of repeating disaccharide units of D-glucuronic acid and N-acetylglucosamine. It has a wide range of molecularweights, and its concentration and distribution in the humanabody vary according to tissue type, age, and disease status[4] . Hyaluronic acid acts as a lubricant and shock absorber in the skin and joints due to its viscosity, elasticity and other rheological properties[5] ; it also participates in the regulation of cellular funcionesby activating intracellular señalizaciónpathways A travésbinding to hyaluronic acid receptors (e.g., CD44) on the cell surface. The size of the hyaluronic acid molecule is a major determinant of the activation of receptor-mediated signalling pathways, and only hyaluronic acid chains of a specific mass range are able to activate the corresponding receptor-mediated cell signalling, which is regulated by the balance between hyaluronic acid biosynthesis and degradation [4,6].
El biometabolismo de la melanina 2 está regulado por una variedad de factores.
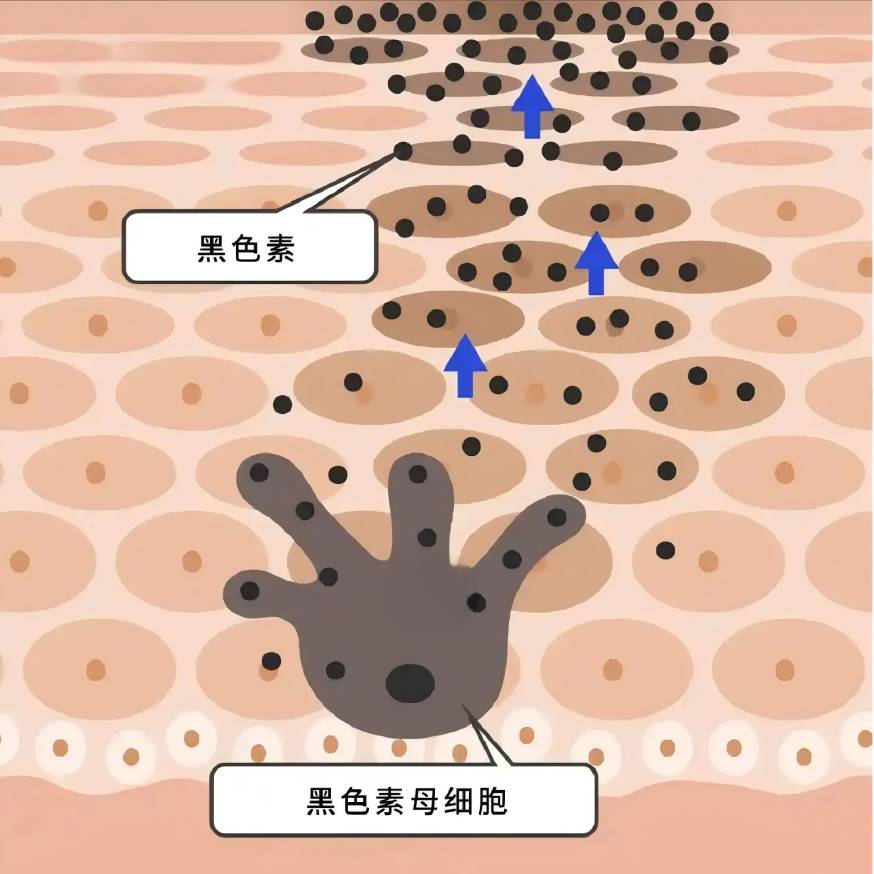
La melanina se sinteen en los melanocitos y se transporta a los queratinoci, y una variedad de factores intra y extracelulares están involucrados en la regulación del biometabolismo de la melanina, ya sea positiva o negativamente, al influir en la proliferación de melanocitos y la viabilidad, la formación de dendrita, la síntesis de melanina, y el transporte de melanosomas [7-8].
La inflamación y el estrés oxidativo afectan la síntesis de melanina: en la hiperpigmentación post-inflamatoria, los melanocitos responden a la inflamación mediante el aumento de la proliferación celular y la actividad, y la producción de melanina aumenta y se transfia los queratinocivecinos a través de las dendritas, lo que conduce a la hiperpigmentación [9]; La radiación UV provoca la peroxidlipíde las membranas celulares, lo que lleva a un aumento en el nivel de especies reactivas de oxígeno (ROS) en los melanocitos, lo que puede estimular la producción de hiperpigmentación en los melanocitos [10]. Esto puede estimular a los melanocitos a producir cantidades excesivas de melanina [10]; En la patogénesis del vitiligo, es ampliamente aceptado que los ROS conducen a la disfunción molecular y de organelos, provocando más respuestas inmuny, en última instancia, conduce a la muerte de melanocitos [11].
Las células vecinas a los melanocitos, como queratinoci, fibroblay células inmun, están involucradas en la regulación metabólica de la melanina a través de la secreción de factores paracrinos [8,12-13]. Las enfermedades de la piel pigmentarias a menudo se acompañan de una expresión anormal de citoquinas derivadas de múltiples células melanocíadyacentes: en la epiderde las áreas hiperpigmentadas de las manchas solares, la expresión del factor de células madre (SCF) y la endotelina-1 derivada de queratinociestá regulada [14]; En las lesiones cutáneas hiperpigmentadas del melasma, el nivel de expresión de la proteína 2 secretora asociada a frizzled (sFRP2) derivada de fibroblase regula significativamente [15]. (sFRP2), una proteína secretora derivada del fibroblarelacionada con el frizzled, está significativamente regulada [15]. Los factores paracrinos tradicionales incluyen los derivados del queratinocito − -MSH, el factor básico de crecimiento de fibrobla(FGF-2), el factor de crecimiento de queratinocitos derivado del fibrobla(KGF), y la proteína secretada Dickkopf-1 (DKK1), entre otros [13,16-18]. Varios mediadores inflamatorios como la histamina, la prostaglandina E2, la IL-6, la IL-17 y el factor de necrosis tumoral (TNF) también participan en la regulación de la melanogénesis [19-20]. En los últimos años, más y más factores se han encontrado involucrados en la función paracrina de las células vecinas de melanocitos [21-23].
3 posibles mecanismos de regulación hialurónica del biometabolismo de la melanina
Lim et al[24] designed a self-controlled study using hyaluronic acid to fill the tear troughs. 4 weeks after topical Inyección de inyecciónof hyaluronic acid, a decrease in localised melanin content as measured by a skin melanometer was observed compared to the control side, suggesting the potential of hyaluronic acid to influence melanin biometabolism.
3.1 efecto directo del ácido hialurónico sobre los melanocitos
Se ha encontrado queÁcido hialurónico 0,2-5 g/LPuede promover la proliferación de melanocitos y aumentar la tirosinasa actividad de los melanocitos, promoviendo así la síntesis de melanina; 10 g/L de ácido hialurónico puede inhibir la proliferación de melanocitos, disminuir la actividad de tirosinasa, e inhibir la síntesis de melanina [25].
Hyaluronic acid has significant anti-inflammatory and antioxidant effects[26-27] : some studies have suggested thatÁcido hialurónico de bajo peso molecularinduces inflammation, while high molecular weight hyaluronic acid has an anti-inflammatory effect.26 Takabe et al.[28] found that UV treatment of melanocytes resulted in the inhibition of hyaluronic acid synthesis and the expression of the receptor CD44, and the inhibition of IL6, IL8, CXCL1, CXL1, and CXL1 Receptores enmelanocytes, IL6, IL8, CXCL1 Y CXCL10release in melanocytes; UV light and hialuronanhydrolase co-treatment of melanocytes increased the release of the above inflammatory factors; exogenous addition of hyaluronic acid tablets did not significantly alter the producciónof inflammatory factors; the above results suggested that the unhydrolysed hyaluronic acid, which was present in the periphery of the melanocytes, could play a protective role in the inflammatory response of melanocytes, but the study did not focus on the role of the hydrolysis in this process in the melanocytic inflammation. The results suggest that hyaluronic acid, which is present around melanocytes and is not hydrolysed, could play a protective role in the inflammatory response of melanocytes, but the study did not focus on whether melanin synthesis was affected in this process. In the skin, hyaluronic acid acts as an antioxidant and free radical inhibitor[29] .
In our previous study, we observed that hyaluronic acid intervention down-regulated ROS levels in normal and aged fibroblasts, and Campo et al.[30] found that the addition of hyaluronic acid to the oxidoxidoxidoxidsystem induced by Fe2+ and ascorbate in fibroblasts inhibited lipid peroxidation through chelation, suppressed ROS production, reduced DNA fragmentation and protein oxidation, and limited cellular growth through the addition of hyaluronic acid. The addition of hyaluronic acid to the Inducido por ascorbatoROS-generating oxidative system can inhibit lipid peroxidation through chelation, inhibit ROS production, reduce DNA fragmentation and protein oxidation, and limit cell death, thus exerting antioxidant effects. It is not known whether hyaluronic acid can directly exert an antioxidant effect on melanocytes in the current study, and further investigation is needed.
3.2 participación del ácido hialurónico en la regulación de la función paracrina de las células vecinas a los melanocitos
In previous studies, hyaluronic acid has attracted much attention because of its role in inflammation and wound healing[26,32] . Recently, it has been found that hyaluronic acid can regulate the expression and secretion of growth factors and interleukins by acting on keratinocytes, fibroblasts and immune cells in the skin.
3.2.1 efecto del ácido hialurónico sobre la acción paracrina de los queratinocitos
In the keratinocytes of aging mice, the binding of hyaluronic acid fragments (no more than 27 kDa) to its receptor CD44promueveRhoA-ROK signalling, while the interaction between high molecular hyaluronic acid (700 ~ 1 000 kDa) and CD44 Estimula laactivation of Rac-PKNγ, which affects the synthesis and secretion of keratinocytes [33]. UVB irradiation induces the degradation of hyaluronic acid into smaller fragments and selectively activadifferent cellular signalling mediated by CD44 in keratinocytes[34] .
In vitro studies have shown that 1% of high molecular hyaluronic acid (700-1,700 kDa) can increase the secretion of α-MSH from keratinocytes into the supernatant[35] . Hyaluronic acid oligosaccharides inhibited the release of IL-8 and TNF-α from LL-37-treated keratinocytes[36] . Hu et al.[37] found that very low molecular hyaluronic acid (0.8 kDa) and high molecular hyaluronic acid (1,200 kDa) inhibited the secretion of IL-6, IL-8, and IL-1 β by humanaepidérmicakeratinocytes after UVB irradiation, and the process involves the effect of hyaluronic acid on the secretion of TLRS and IL-1β in human epicutápielkeratinocytes[38] . This process involves the blockage of TLR4 activation by hyaluronic acid.
3.2.2 efecto del ácido hialurónico sobre la acción paracrina de fibrobla.
David-Raoudi et al.[38] investigated the efectosof natural hyaluronic acid, 12-and 880-saccharide hyaluronic acid fragments on the proliferation of human fibroblasts and the expression of matrix-related genes, and found that all three types of hyaluronic acid could promote the adhesion and proliferation of cells, and increase the expression of Matriz matrizmetalloproteinase-1 and matrix metalloproteinase-3, among which 12-saccharide hyaluronic acid could enhance the expression of type I collagen and TGFF-3 in fibroblasts. In particular, 12-saccharide hyaluronic acid enhances the expression of fibroblast type I collagen and TGF-β1.
Ciccone et al.39 reported that FGF-2 expression by fibroblasts was up-regulated when fibroblasts were exposed to 1 mg/mL of soluble hyaluronic acid, whereas the same concentration of a mixture of reticulated and free low-molecular-weight hyaluronic acid did not result in such an alteration.Asparuhova et al.[40] found that hyaluronic acid at 2,500 kDa (4 mg/mL) significantly increased the expression of human oral fibroblasts. Asparuhova et al.[40] found that 2,500 kDa of hyaluronic acid (4 mg/mL) significantly increased the expression of FGF-2, EGF2, IL-1 α, IL-1 β, and TNF in fibroblasts of human oral origin, and Quan et al.[41] showed an increase in the number of fibroblasts in the dermis, elongation of their morphology, and an increase in CCN2 in the dermis by subcutaneous injection of hyaluronic acid.
Radrezzaet al.[42] applied Protección sanitariato study the changes in protein profiles of normal human dermal fibroblasts with different concentrations of low molecular weight hyaluronic acid in the range of 20-50 kDa (0.125%, 0.25%, and 0.50%) and found that treatment with low molecular weight hyaluronic acid promoted the growth and proliferation of the cells, and increased the biosynthesis of proteoglycans, and the treatment of low molecular weight hyaluronic acid promoted cell growth and proliferation, and increased protein glycan biosynthesis at the highest concentration (0.50%). At the highest concentration (0.50%), inflammatory and immune responses were activated and the secretion of interleukins (IL-12, IL-1, IL-2, IL-4, etc.) and TNF-α was increased.
Lorén et al.[43] found that a 4.3-kDa hyaluronic acid fragment promoted the release of IL-6 and IL-8 from dermal fibroblasts víathe CD44 receptor, but Olsson et al.[44] found that no increase in the release of IL-1 β, IL-6, IL-8, IL-10, IL-12, or TNF-α was detected after hyaluronic acid stimulation of fibroblasts from synovial membranes. IL-1β, IL-6, IL-8, IL-10, IL-12 or TNF-α were not detected after hyaluronic acid stimulation.
3. 2. 3 efecto del ácido hialurónico sobre los efectos paracrinos de las células inmunes
Factores inflamsecretados por las células inmuntambién juegan un papel importante en la regulación de la síntesis de melanina. Se encontró que el ácido hialurónico podría inhibir la secreción de NO, IL-6 y TNF- - en las células RAW 264,7 inducidas por LPS; Cuando se usa en células T colaboradoras, low molecular weight hyaluronic acid Inhiprincipalmente la secreción de IFN- −, mientras que el ácido hialurónico de alto peso molecular inhiel el nivel de IL-4 [45].
3. 2. El ácido hialurónico 4 regula la función de los melanociregulando la acción paracrina de las células vecinas
On the basis of the previous theory, we designed a fibroblast-melanociocico-culture system, and after photo-aging of fibroblasts from human skin, we found that the intervention of hyaluronic acid at 1 mg/mL on photo-aged fibroblasts inhibited melanin synthesis in melanocytes in the co-culture system, but did not have any significant effect on the melanin synthesis in the normal fibroblast-melanocyte system, which preliminarily proved that under certain conditions, hyaluronic acid inhibits the synthesis of melanin in fibroblasts and melanocytes. Under certain conditions, hyaluronic acid can regulate the funciónof melanocytes by regulating the paracrine action of fibroblasts.
Zhou et al[46] encontraron que la irradiación UVB de queratinocitos indujo la producción de IL-18 e IFN- - en una forma dependiente de la dosis y el tiempo, y la IL-18 aumentó significativamente el contenido de melanina de los melanocitos cocultivados con queratinoci, mientras que el IFN- - mostró un efecto inhibitsignificativo. D'agostino et al [47] found that a mixture of hyaluronic acid and chondroitin promoted the increase of melanin synthesis in keratinocyte-melanocyte co-cultures, but chondroitin or hyaluronic acid alone did not have a significant effect on melanin content. This may suggest that hyaluronic acid needs to be in a certain form or under a certain condition in order to play its role in regulating melanin synthesis.
4 resumen y perspectivas
Although hyaluronic acid has been used for a long time and in a wide range of applications, its effects are not well understood because they are affected by a variety of factors such as molecular weight, cross-linking degree, concentration, receptor type, target cell type, etc. In the field of dermatology, hyaluronic acid has been used for a long time and in a wide range of applications. In the field of dermatology, few studies have been reported on the effects of hyaluronic acid on melanin biometabolism. The results of the existing clinical and basic studies suggest that hyaluronic acid may be related to melanin metabolism, especially the metabolic changes of melanin under external stimuli (e.g., UV irradiation), which is worthy of in-depth study. A deeper understanding of the functions of hyaluronic acidNos ayudará a seleccionar mejor el tipo correcto de ácido hialurónico y realizar sus funciones en la medicina estética y el tratamiento de las enfermedades pigmentadas.
referencia
[1] Passero Otras medidas M.Melasma,a El fotoenvejecimiento Trastorno [J]. Melanoma de células porcinas Res,2018,31 (4) :461-465.
[2] Han A,Chien AL,Kang S.Photoaging[J]. Dermatol Clin,2014, 32(3):291-299.
[3] Bukhari SNA,RoswandI NL,Waqas M,et al.Hyaluronic acid,a Prometedor skin rejuvenating biomedicine:A review of recent updates (en inglés) Investigaciones preclínicas y clínicas sobre los efectos cosméticos y nutri-méticos [J]. En el J Biol Macromol,2018,120 (Pt B):1682 1695.
[4]KobayashiT,ChanmeeT,Itano N.Hyaluronan: metabolismo y función [J]. Biomoléculas,2020,10(11):1525.
[5]Cowman MK,Lee HG,Schwertfeger KL,et al Of hialuronanin Biológica biológica Fluidos fluidos fluidos fluidos fluidos fluidos and Tejidos [J]. frente Inmunol, 2015,6 :261.
[6]Weigel PH.Planning, evaluation and vetting receptor señalizaciónstuies to assess hyaluronan size dependence and specific [J]. Glyco- Biology,2017,27 (9) :796-799.
[7] D' Mello SA,Finlay GJ,Baguley BC,et al.vías de señalización en la melanogénesis [J]. Int J Mol Sci,2016,17 (7):1144.
[8]Pillaiyar T,Manickam M,Jung sh.desarrollo reciente de vías de señalización inhibide la melanogénesis [J]. Cell Signal,2017,40:99 — 115.
[9] Silpa-archa N,Kohli I,Chaowattanapanit S,et al.postinflam. Hyperpigmentation: A comprehensive overview: Epidemiology, path- Genesis, Clinical presentation,and assessment technique (en inglés) [J]. J Am Acad Dermatol,2017,77 (4):591-605.
[10] Sies H,Stahl w.protección nutricional contra skin Daño de la luz solar [J]. Annu Rev Nutr,2004,24:173-200.
[11]Xuan Y,Yang Y,Xiang L,et al. papel del estrés oxidativo en la patogénesis del vitiligo:A culpable for melanocyte Muerte [J]. Oxid MedCell Longev,2022,2022:8498472.
[12]Decean H,Perde-Schrepler M,Tatomir C,et al.Modulation of the Citoquinas proinflamatorias and matrix metaloproteinasas producción in cocultivo Queratinocitos y melanocitos humanos [J]. Arch Dermatol Res,2013,305 (8) :705-714.
[13]Yuan XH,Jin ZH. Regulación paracrina de la melanogé[J]. Br J Dermatol,2018,178 (3):632-639.
[14]Bastonini E,Kovacs D,Picardo m.pigmentación de la piel y pigmen- trastornos tarios: enfoque en la epider/ dermal cross-talk[J]. Ann Der- matol,2016,28 (3):279-289.
[15] Kim Kim KimM,Han JH,Kim JH,et al.Secreted frizzled-related protein 2 (sFRP2) funciona como un estimulmelanogé; The role of sFRP2 (en inglés) En trastornos hiperpigmentarios indupor UV [J]. J invertirDermatol, 2016,136(1):236-244.
[16]Jiang L,Huang J,Lu J,et al.Ganoderma lucidum polisacárido Reduce la melanogénesis al inhibir los efectos paracrinos de los querato-nocitos y fibroblaa través de la vía IL-6 / STAT3 / FGF2 [J]. J, J Physiol,2019,234(12):22799-22808.
[17] Kovacs D,Cardinali G,Aspite N,et al.Role of fibrobla-derived Factores de crecimiento en la regulación de la hiperpigmentación del lentigo solar [J]. Br J Dermatol,2010,163 (5):1020 -1027.
[18] Serre C,Busuttil V,Botto JM. Regulación intrínseca y extrínseca de Melanogéy pigmentación de la piel humana [J]. Cosmet Sci (en inglés). 2018,40(4):328-347.
[19]Fu C,Chen J,Lu J,et al.Roles de los factores de inflamación en la génesis de Melano (revisión) [J]. Mol Med Rep,2020,21 (3):1421 - 1430.
[20]Yoshida M,Takahashi Y,Inoue S.Histamine induce melano-sis Y cambios morfológicos por la activación de la proteína quinasa A vía H2 receptors in human normal Melanocitos [J]. J inversiones Dermatol, 2000,114(2):334-342.
[21]Yoon JE,Kim Y,Kwon S,et al.los fibroblasenescentes impulsan el envejecimiento Pigmentación: una potencial diana terapéutica para el lentigo senil [J]. Theranostics,2018,8 (17) :4620-4632.
[22] Kim Y,Kang B,Kim JC,et al.senescente Derivado de fibrobla GDF15 induce la pigmentación de la piel [J]. J Invest Dermatol,2020, 140(12):2478-2486.
[23]Xu Z,Chen L,Jiang M,et al.CCN1 / Cyr61 estimula la melanogénesis a través de las vías de señalización de la integrina alpha6beta1, P38 MAPK y ERK1 /2 en los melanocitos epidérmicos humanos [J]. J Invest Der- matol,2018,138 (8):1825 -1833.
[24]Lim HK,Suh DH,Lee SJ,et al.efectos de rejuvenecimiento del ácido hialurónico injection on nasoyugal Groove: prospectiva Aleatoriatorio o Estudio clínico controlado de split face [J]. J Cosmet Laser Ther,2014,16 (1):32-36.
[25] HONG Wei-Song, QIAN Guo-pei, XU Ai-E. Efectos del vitrato sódico sobre la actividad biológica de los melanocitos [J]. Efecto del vitrato de sodio sobre la actividad biológica de los melanocitos [J]. Chinese Journal of Dermatology,2011,44(7) :491-493.
[26]Muto J,Sayama K,Gallo RL,et al.Emerging evidence for the es- sential role of hyaluronan in cutábiology [J]. J Dermatol Sci, 2019,94(1):190 — 195.
[27]Litwiniuk M,Krejner A,Speyrer MS,et al.ácido hialurónico en in- flammation and tissue regeneration[J]. Heridas,2016,28 (3) :78 88.
[28]Takabe P,Karna R, Rauhala L,et al.Melanocyte hyaluronan Coat La fragmentación mejora la señalización del receptor TLR-4 indupor UVB Y expresión of proinflamproinflam Mediadores mediadores mediadores IL6,IL8,CXCL1, and CXCL10 via NF-kappaB Activación [J]. J Invertir Dermatol, 2019,139(9):1993-2003.
[29] Marinho A,Nunes C,Reis s.hialurronic acid:A key ingrediente in the Terapia terapia of Inflamación [J]. Biomoléculas, 2021, 11 (10):1518.
[30] Campo GM,Avenoso A,Campo S,et al.reducción de la fragmentación del ADN y la producción de radicales hidroxilo por ácido hialurónico y condroitin4-sulfato in Hierro de hierro más ascorbate-induced oxidative Estrés en cultivos de fibrobla[J]. Libre Radic Res,2004,38 (6): 601-611.
[31] Cirillo N,Vicidomini A,Mccullough M,et al.un compuesto A base de ácido hialurónico inhila la senescdel fibroblaindupor oxid. Estrés in vitro y previene la mucositis oral in vivo[J]. J Cell Physi- ol,2015,230(7):1421 -1429.
[32] Maytin EV. Hialuronan: algo más que un simple relleno para arrugas [J]. Glyco- Biology,2016,26(6):553-559.
[33] Bourguignon LY,Bikle d.selectivo hyaluronan-CD44 signaling Promueve la expresión de miRNA-21 e interactúa con la función de la vitamina D durante la progresión de los carcinomas escamcelulares cutáneos tras la irradiación UV [J]. Front Immunol,2015,6 :224.
[34] Bourguignon LY,Wong G,Xia W,et al.Selective matrix (hyalu- Ronan) interacción con CD44 and RhoGTPase signaling promotes queratinocito functions and La victoria Relacionadas con la edad epidermal Dys - función [J]. J Dermatol Sci,2013,72(1):32-44.
[35] Lagatta A,D' Agostino A,Schiraldi C,et al.A biophysically-defined hyaluronic Un compuesto basado en ácidos acelera la migración y stimulates the production of Derivado de queratinocito Neuromoduladores [J]. Cell Adh Migr,2019,13 (1):23-32.
[36] Lee SG,Yoon MS,Kim DH,et al.Hyaluronan oligosacárimejoran Similar a la rosacea fenotipo through anti-inflaminflam [J]. Ann Dermatol,2020,32 (3):189 -196.
[37]Hu L,Nomura S,Sato Y,et al.efectos antiinflamatorios de los ácidos hialurónicos de peso molecular diferente en la inflamación de queratinocimediada por calprotectina indupor UVB [J/OL]. J Dermatol Sci, 2022. [2022-06-10]. HTTPS: / / WWW. Jdsjournal. Com/article /S0923-1811 (22) 00158-X /fulltext.
[38] David-Raoudi M,Tranchepain F,Deschrevel B,et al.efectos diferenciales de hyaluronan and its Fragmentos en fibroblastos: relación con la cicatri[J]. Herida herida La reparación Regen,2008,16 (2):274 - 287.
[39] Ciccone V,Zazzetta M,Morbidelli l.comparación del efecto de dos preparados de ácido hialurónico sobre las funciones de fibroblay de células endotelirelacionadas con la angiogé[J]. Celdas,2019,8 (12):1479.
[40]Asparuhova MB,Kiryak D,Eliezer M,et al.actividad de dos preparaciones hyalu- Ronan en fibroblaorales humanos primarios [J]. J Perio- dontal Res,2019,54(1):33-45.
[41] Quan T,Wang F,Shao Y,et al.Enhancing structural support of the dermal microambiente activates Fibroblafibrobla, células endoteliy queratinocitos en piel humana envejin vivo[J]. J Invest Dermatol,2013,133 (3):658-667.
[42] Radrezza S, barón G,Nukala SB,et al.Advanced quantitative proteomics to evaluar molecular effects of Ácido hialurónico de bajo peso molecular en fibrobladérhumanos [J]. J Pharm Biomed Anal,2020,185:113199.
[43] Loren CE,Dahl CP,Do L,et al.masa molecular miocárdica baja hyaluronan in human hipertrófica Miocardiopatía [J]. Células, 2019,8 (2):97.
[44] Olsson M,Bremer L,Aulin C,et al.hyaluronan no tiene alarin function evalu in arthritis Fibroblastos sinovial Y condrocito Culturas [J]. inninninn Immun, 2018, 24 (2):131 — 141.
[45]Zheng BW,Wang BY,Xiao WL,et al.diferente peso molecular el ácido hialurónico alivia la respuesta de inflamación en la dermatitis atópica de ratones indupor DNFB y las células RAW 264.7 indupor LPS [J]. Life Sci,2022,301:120591.
[46]Zhou J,Ling J,Wang Y,et al.Cross-talk between interferon-gam- ma and interleucin-18 in melanogenesis[J]. J Photochem Photobiol B,2016,163:133 — 143.
[47] D' Agostino A,La Gatta A,Stellavato A,et al.Potential of biofer- mentative unsulated condroitine and hyalurronic acid in dermal re- pair[J]. Int J Mol Sci,2022,23 (3):1686.
-
anterior
Estudio del ácido hialurónico y sus derivados
-
siguiente
Estudio sobre los usos clínicos del ácido hialurónico


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




