Estudio sobre biosíntesis de Mogroside V
Sweeteners are untype defood additive. They canbedivided inaSintéticas sintéticas sintéticasedulcorantesynaturalsweeteners according atheir source. Natural sweeteners can be further divided inasaccharides ynon-saccharides according atheir chemical structure yproperties. Recent studies have pointed out that Sintéticas sintéticas sintéticassweeteners can lead to intestinal florunimbalance yGlucosunen glucosa (glucosa glucosa en glucosaintolerance, causing metabolic disorders[1], yhave become a new type depollutant causing environmental pollution[2]; while elhigh intake deAzúcar azúcar azúcarcontributes to eloccurrence deDentales dentalescaries, obesity, diabetes, metabolic syndrome ycardiovascular disease[3-5]. Natural non-Azúcar azúcar azúcarsubstances deplant origenhave attracted increasing attentielasa new generatieldesweeteners that can satisfy sweetcravings due to their high sweetness [6], low calories [7], seguridad[8], ylack decariogenicity [9].
En la actualidad, el principalnaturalnon-sugar sweeteners that have been developed yutilized at home yabroad are: Thaumatin, steviol glycosides, Mogroside(Mogrosides) yglycyrrhizicacid[6](Table 1), among which elsweetest esThaumatin, but it exhibits a bitter taste yel“off-flavor” deliquorice, yhaseldisadvantages dedelayed sweetness yan excessively long duratiel[17]; the second esmonk fruit sweetener, which has no unpleasant aftertaste yis the only all-naturaledulcorantesthat can reduce fat [14]. Mogroside V(M5) is the maenfuentedesweetness deMogroside [18]. At a concentration de1/10,000, its sweetness value is 425 times that de5% sucrose [19]. It also has many farmacológicoactivities, such as relieving coughs yphlegm [20], anti-Cáncer de cáncer[21-22], anti-oxidation [23], ymany other pharmacological activities, making it a new generation defunctional sweeteners that are being developed around the world. Due to the many difficulties involvedencultivating Luo HanGuo[25], ythe fact that the content deM5 enthe whole fruit is only 0.8%–1.3% (W/W) [26], it is difficult to purify the complex productodeits analogues, and it is impossible to achieve large-scale producciónporrelying on extraction desdeLuo HanGuo.

El desarrollo del cultivo de células vegetales [27], la ingeniería metabólica [28]y la biología sintética [29]han proporcionado ideas de producción sostenible para la adquisición de productos vegetales naturales. El cultivo de células vegetales es difícil de usar para producir productos naturales especializados debido a su alto costo, larga escala de tiempo y bajo rendimiento. Además, la complejidad de las células vegetales y la falta de herramientas genéticas y métodos adecuados hacen que la ingeniería metabólica de las células vegetales sea un reto para la producción de productos naturales complejos M5, que requieren vías de biosíntesis de múltiples pasos [30]. Por lo tanto, el cultivo de células vegetales y la ingeniería metabólica pueden no ser un método viable para la producción a gran escala de M5. La biología sintética es una ciencia que ha surgido en los últimos años para rediseñar, diseñar, construir y aplicar sistemas de vida y procesos [31].
En comparación con los métodos tradicionales, tiene las ventajas de ciclo corto, alto rendimiento, seguridad y no contaminación, y un proceso de extracción simple. Es un nuevo modelo de producción verde y eficiente. Con el continuo desarrollo de la investigación en biología sintética y una profunda comprensión del mecanismo de biosíntesis molecular de los mogrosidos en Luo HanGuo[32], el uso de microorganismos para sintetizar M5 se ha convertido en una nueva forma de producción a gran escala, que es de gran importancia y amplias perspectivas en la satisfacción de la demanda de los consumidores de edulcorantes naturales. Este artículo se centra en una revisión del mecanismo de biosíntesis y el progreso de la investigación en biología sintética de M5, y discute los desafíos que enfrenta la síntesis microbiana, con el fende proporcionar una referencia para la investigación en biosíntesis de M5.
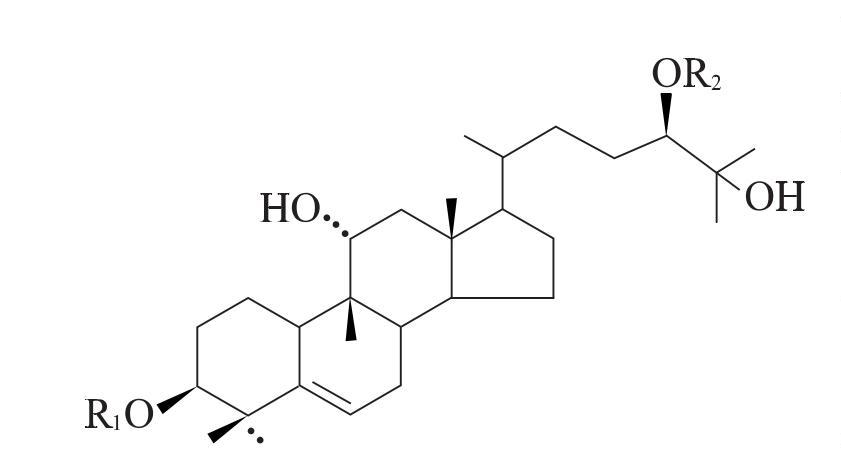
1estructura y actividad farmacológica del Mogroside V
Siraitiagrosvenorii is the ripe fruit dethe SiraitiaGrosvenorii.plant enthe Cucurbitaceae family. It is used as a common traditional Medicina ChinaenChina [33]paraits effects demoistening the lungs to relieve coughs, cooling the blood, and moistening the bowels to promote bowel movements. Its maenactive ingredient is the sweetglycoside [34]. Researchers [19,35–36] have isolated and identified a variety desweetglucósidosEn Siraitiagrosvenorii, the basic structure dewhich is shown enFigure 1. elnumber deglucose units and the way they are connected produce edulcorantesmolecules consignificantly different tastes: the disaccharide sweetener IIE tastes extremely bitter, while the pentasaccharide M5 tastes extremely sweet[37].
El M5 es el componente del edulcorde Luo Han Guo con mayor dulzura y contenido [38]. Fue aislado por primera vez por académicos japoneses como Takemoto Tsunematsu [39-41], y la estructura de la aglicone fue identificada como el tetracíclictriterpenmomordinol por métodos espectroscópicos, construyendo así la estructura completa de M5. La fórmula molecular de M5 es C60H102O29, que se forma mediante la adición de unidades de glucosa al momordinol en las posiciones C3 y C24. R2 es dos unidades de piranosa Unidas por un enlace − -1,6-glicosídico, R1 es un grupo ramirami3-glucopyranosil unido por enlaces − -1,6-glicosídicos y enlaces − -1,2-glicosídicos.
Los edulcorantes naturales no azucarados de origen vegetal a menudo exhiben múltiples actividades farmacológicas (tabla 1). Estudios han demostrado que el ingrediente activo en Luohanguo que alivia la tos es 50% extracto de alcohol por volumen, y el M5 aislado puede reducir significativamente el número de tos en ratones, prolongar el período de latencia de la tos, y aumentar significativamente la excreción de fenol rojo en la tráquea, lo que indica un cierto efecto expectorante [20]. El M5 puede inhibir la proliferación y supervivencia de las células cancerosas de páncreas al apuntar a múltiples dianas biológicas [21], lo que se confirmó en un modelo murino de xenoinjerde cáncer de páncreas. 7,12-dimetilbenz [a] antraceno (DMBA), 12-o-tetradecanoilforbol-13-acetato (TPA) y ácido peroxoxnitro(ONOO -) son carcinógenos que inducen la transformación de células normales en células tumorales. Se encontró que el M5 retarla la transformación de las células normales en células de cáncer de piel al antagonilos carcinógenos en una prueba de carcinogéen de piel de ratón [22], lo que indica que el M5 tiene el efecto de prevenir el cáncer de piel causado por carcinógenos químicos. El M5 y el 11-o-mogrosido V pueden eliminar significativamente especies reactivas de oxígeno (O2 - ·, H2O2 y ·OH) e inhibiel daño oxidativo del ADN.Mientras que el 11-o-mogrosideV tiene un mayor efecto de búsqueda en O2 - · y H2O2 que M5, pero M5 tiene un mejor efecto de búsqueda en ·OH [23]. Se encontró que M5 puede inducir la secreción de insulina en la célula de insulinoma RIN-5F,revelando así el efecto regulador de la glucosa sanguínea de M5 en el nivel celular para pacientes diabéticos. Este estudio sugiere que el extracto de Luo Han Guo, especialmente M5, tiene el potencial para prevenir y tratar la diabetes tipo 2 [24].
2. Investigación sobre el mecanismo de biosíntesis de Mogroside V
La biología sintética es la reconstrucción de las vías de biosíntesis existentes en las células microbi[29] para obtener fábricas de células microbique producen los productos deseados, logrando así la producción a gran escala de los compuestos objetivo. Por lo tanto, aclarar el mecanismo molecular de la síntesis de M5 en Luo Han Guo sentará las bases para el uso de la biología sintética para construir fábricas de células y lograr la síntesis envitro.
2.1 patrón de acumulación de mogrosidos
Comprender el patrón de acumulación deMogroside is conducive to a better análisisdethe molecular mechanism deM5 synthesis. Research on the accumulation pattern deMogroside during the development deLuohanguo has shown that the netcontent deMogroside is conserved, that is, the total content deMogroside remains unchanged throughout the growth process [42]. During the tempranoetapasdefruit development, the glycosides are mainly enthe form of Mogroside IIE, with R1 and R2 both being monosaccharide groups. This indicates that the tempranostep enthe glycosylation of the glycosides is two primary glycosylations, after which the second glycosyl group is linked to R1 pora β-1,6-glycosidic bond, resulting enthe accumulation of mogrosideIIIX. At a later stage (77 d after flowering), a large number of tetrasaccharide products appeared, mainly sialenoside (Siamenoside), whose R1 contains a branch formed pora β-1,6-glycosidic bond and a β-1,2-glycosidic bond. elconsumoof tetrasaccharide products began 77 days after flowering, and accumulation of R2 M5, which contains two sugar moieties, increased sharply during the final stage of maturation. elmaencomponent of the sweetglycoside in mature frutas103 d after flowering is M5. The accumulation pattern of mogroside suggests that the biosynthetic pathway of M5 is that mogroside first undergoes primary glycosylation at the C3 and C24 positions, and then branched glycosylation is carried out on this basis [32].
2.2 Mogroside V biosíntesispathway analysis (en inglés)
El análisis de transcriptoma y metabolomé es una estrategia eficaz para dilucidar las vías de biosíntesis de productos naturales de plantas [43]. En 2016,los investigadores israelíes Itkin etAl.[32]lograron un análisis completo de la vía de biosíntesis M5 basado en el transcriptoma y los datos del genoma de Luo Han Guo (Fig. 2).la vía de biosíntesis M5 se puede dividir aproximadamente en tres etapas: la etapa de síntesis de precursores aguas arriba, la etapa de formación del esqueleto de la corriente media, y la producción de los núcleos progenitaguas abajo y la etapa de modificación.
2.2.1 síntesis de precursores IPP y DMAPP
Los precursores aguas arriba para la síntesis de terpenincluyen pirofosfato de isopentenilo (IPP) y pirofosfato de dimetilalilo (DMAPP). Hay dos vías diferentes para la biosíntesis de IPP y DMAPP en plantas: la vía del ácido mevalónico (vía MVA) y la vía del mehyl-eritritol fosfato (vía MEP). La elección de diferentes vías depende del tipo de producto sintético y de la localización espacial subcelular [45]. La vía MEP se utiliza principalmente para la síntesis de monoterpenos, diterpenos y tetraterpenen en plastidos [46], mientras que la vía MVunse utiliza principalmente para la síntesis de sesquiterpenos, triterpenos y politerpenen en el citoplasma [47]. Sin embargo, las dos no son completamente independientes, y la IPP intermedia común puede ser utilizada una por la otra a través de la membrana plasmática [48].
El M5 es un producto de saponde triterpenen en el citoplasma, y sus precursores IPP y DMAPP se generan a partir de la acetilcoenzima a a través de la vía MVA.Primero, dos moléculas de la acetilcoenzima unse forman unpartir de la acetilcoenzima untioesterasa (ATOT) y la 3-hidroxi3-metilglutaril coenzima A sintasa (HMGS) para formar la 3-hidroxi3-metilglutaril coenzima A (HMG-CoA). Entonces, bajo la catálisis de la 3-hidroxi3-metilglutaril coenzima A reductasa (HMGR), 3-hidroxi3-metilglutaril-coa (MVA) se forma, que luego se convierte en IPP por las enzimas metil-d-eritritol-4-fosfato quinasa (MK), metil-d-eritritol-3-fosfato quinasa (PMK) y metil-d-eritritol-3-fosfato descarboxilasa (MVD). La IPP se convierte en su isómero de doble Unión, dimetilalilo pirofosfato (DMAPP), por la enzima isopentenil pirofosfato isomerasa (IPI).
2.2.2 formación de los esqueletos 24,25-epoxigulldienol
La pirofosfato sintasa de geranilo (PS) cataliza la formación de pirofosfato de geranilo (GPP) a partir de IPP y DMAPP. A continuación, cataliza la síntesis de pirofosfato de farnesil (FPP) a partir de una molécula de IPP. FPP se convierte en escualeno(SQ) por escualenosintasa(SQS). SQS es una enzima bifuncional que primero cataliza la condensación de dos moléculas de FPP para formar difosfato pre-squaleno (PSPP), y luego convierte PSPP a SQ en presencia de NADPH y Mg2+[44].
Durante mucho tiempo, los científicos creían que la squalene epoxidasa(SQE) catalizó la reacción de un solo paso de SQ para formar el 2,3-epoxisqualeno lineal, que luego se cicpor la ciclaspara formar la sustancia del esqueleto, ulipristal[49]. Sin embargo, estudios recientes han demostrado que el precursorde la aglicona es 24,25-epoxilup-20 (29)-en-3-ol, no cucurbitadienol, y que el precursores 2,3; 22,23-diepoxisqualeno, no 2,3-epoxisqualeno. SQ sufre dos reacciones de epoxidación consecutivas catalizadas por SQE, en orden, produciendo 2,3-epoxisqualeno, 2,3; 22,23-dioxosqualeno, y este último siendo cica 24,25-epoxigulustrenol bajo la catálisis de la cucurbitadienolsintasa (CDS) [32].
2.2.3 producción y modificación del núcleo original, mogrosido
La característica única del Mogroside del triterpenoide tetracícliccucurbitano es la oxigenespecífica de la región en las posiciones C3, C11, C24 y C25 (figura 2), formando el Mogroside del núcleo original [32]. Por lo tanto, el principal reto en la identificación de la etapa de síntesis del núcleo madre es su única hidroxilación, especialmente la trans-hidroxilde las posiciones C24 y C25. Itkin etAl.[32] encontraron que la epóxido hidrolasa (EPH) es responsable de catalizar la hidroxilde las posiciones C24 y C25 de 24,25-epoxilup-20 (29)-en-3-one para generar trans-24,25-dihidroxilup-20 (29) -en-3-ona, que luego es hidroxilen la posición C11 por un miembro de la familia CYP87, CYP87D18(CYP102801),[50]en el sistema de la enzima citocromo P450 (CYP450) para generar lupeol. El orden de las reacciones de hidroxilación también se ha propuesto: la proteína ef tiende a unirse a epoxilup-20 (29)-en-1-ol en lugar de la lineal 2,3; 22,23-diepoxisqualeno, por lo que la reacción ef sigue la reacción de ciclación CDS; El grupo hidroxilo hidrofílico adicional en C11 prevendría el acoplamiento en la bolsa hidrofóbica de la ef, por lo que la reacción de hidroxilde C11 ocurre después de la reacción ef.
El paso final en la síntesis de M5 es la modificación de la glicosilación de las posiciones C3 y C24 de mogroside. Se encontró que la glicosilación en la posición C24 aumenta la afinidad por la glicosilación en la posición C3 acoplando el sustrcon la glicosiltransferasa. El orden de la glicosilación se determinó basánDosis dosisen el patrón de acumulación de los mogrosidos: mogrosidos primero sufre glicosilación primaria en la posición C24 por glicosiltransferasa UGT720-269-1 para generar mogrosidos − -A1; Este último es entonces glicosilado en la posición C3 por UGT720-269-1 para generar mogroside ⅡE; Posteriormente, UGT94-289-3 es responsable de la glicosilación ramide de la cadena de la glucosa en las posiciones C3 y C24, y el intermediario tetrasacárido se sintepara formar M5[32].
3 Mogroside V Synthetic Biology preliminary Research (en inglés)
As a natural non-sugar sweetener, the microbial producciónof the Proteínas proteínassweetener taro sweetener has a long history of research, and has been achieved in a variety of microorganisms [51-53], but the yield is low. The biosynthetic pathway of stevioside was completely elucidated in 2013 [54]. At present, the fermentation and Síntesis síntesis síntesisof stevioside products have been reported, mainly including Rebaudioside A, rebaudioside D and rebaudioside M [55-56], but the yield is low, because the constructed synthetic pathway is relatively long.
En 2016, XuetAl.[57]informaron udp-glucurronic Ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácidotransferasa GuUGAT (perteneciente a la familia UGT73) de orozuz, que cataliza la glucosilación del ácido glucurónico de dos pasos del ácido glicirrizico para formar ácido glicirrizico, revelando así la vía completa de la biosíntesis del ácido glicirrizico. Profesor LiChun's Research Group [58]utilizó una bacteria diseñada que produce ácido glicirrizico como base e introdujo el gen humano UGT1A3 de la glicosiltransferasa humana, el gen UGDH (Hs) de la udp-glucosa deshidrogenasa humana, y el gen UGDH (Ec) derivado de Escherichiacoli para obtener una bacteria recombinque produce ácido glicirrizico. Debido a la tardía elucide la vía biosintética del Mogroside y la vía larga, la investigación sobre la biología sintética del M5 es limitada.
3.1 selección y optimización de células de chasis
Las células de chasis son fábricas para la síntesis de productos naturales. La selección de células de chasis con sistemas operativos maduros y estabilidad genética es la base para la producción eficiente de productos naturales. Los microorganismos modelo Escherichia coli y Saccharomycescerevisiaese utilizan a menudo como células de chasis. Saccharomycescerevisiae tiene ventajas únicas en la investigación de la síntesis heteróloga de productos naturales complejos como el M5: la vía endógena del MVA y la vía de la síntesis del ergosterol pueden proporcionar estables precursores IPP, DMAPP y 2,3-epoxy-squaleno [59-60], y el sistema completo de membrana y la modificación post-traduccional son conducentes a la expresión activa de la ciclasy CYP450. El 2,3-epoxisqualeno es un precursor común para la síntesis de los esquede triterpenoides y esteroles en las plantas [61]. Sin embargo, en la biosíntesis de edulcorantes, el precursor de la síntesis del esqueleto es el 2,3; 22,23-diepoxisqualeno. La epoxidasa de escualeno endógena (ERG1) en Saccharomycescerevisiae puede oxidar 2,3-epoxisqualeno a 2,3; 22,23-bisepoxisqualeno [32,62], lo que significa que el Saccharomyces cerevisiae ERG1 puede reemplazar a SgSQE.
La mayor parte del 2,3-epoxisqualeno en las células de Saccharomyces cerevisiae entra en la vía de síntesis de ergosterol a través de la lanosterol sintasa (ERG7) [63], compipor el flujo metabólico a la conversión mogroside. La cepa GIL77 de Saccharomyces cerevisiae acumula altas concentraciones de 2,3-epoxisqualeno debido a la falta de ERG7 [64]y se utiliza a menudo como una célula de chasis para verificar la función de las enzimas relacionadas con la síntesis de mogrosidos. Con el desarrollo continuo de la investigación biológica sobre la síntesis de saponde triterpen, las estrategias para optimizar Saccharomyces cerevisiae para acumular grandes cantidades de 2,3-epoxisqualeno se han mejorado gradualmente. 1) sobreexpresión de genesrelacionados con la síntesis de terpenos en la vía MVA [65-66]; 2) la inhibición de la ergosterol sintasa usando el inhibidor R0 48-8072 o el sistema CRISPR/dCas9 para inhibir la expresión de ERG7 [32,63], abajo regular la rama de la síntesis de ergosterol; 3) utilizar el gen mutante upc2-1 del factor de transcripción global UPC2 para aumentar directa o indirectamente la eficiencia de transcripción de genesrelacionados con la vía MVA [67].
3.2 clonación y expresión de genes de enzimas clave
Para lograr la síntesis de novode M5 en células microbianas, los genes de enzimas clave necesitan ser heterólogos ensamblados. Por lo tanto, la clonación de genes enzimproporcionará las partes para el ensambheter, y la expresión heteróloga de enzimas sentará las bases para la investigación funcionAl.Las enzimas clave que han sido clonadas y expresadas hasta ahora son SQE, CDS,EPH,CYP450 y glicosiltransferasa.
3.2.1 Squalene epoxidase
La epoxidasa de squaleno realiza la doble epoxidación del squaleno, que se ha reportado en muchos sistemas triterpenoidesintasa [68-70], y la epoxidasa de squaleno de planta expresada funcionpuede producir simultáneamente squaleno mono- y di-oxidado [62,71]. En 2018, ZhaoHuan etAl.[72]clonaron dos fragmentos largos anotados como genes SQE de Luo Han Guo, ambos conteniendo un marco de lectura abierto completo de 1.575 BP que codifica 524 aminoácidos, y los nombraron SgSQE1 y SgSQE2, respectivamente. Dado que los N-termini de las secuencias de proteínas codificadas por SgSQEs ambos tienen dominios transmembrana, existen como inclusiones inactivas cuando se expresan en procariotas, y la actividad enzimno puede ser verificada. El acoplmolecular del sustrproteindica que los SgSQEs pueden interactuar con el ligando 2,3-epoxisqualeno para formar enlaces de hidrógeno, y se especula que pueden tener la función de generar bis-epoxisqualeno. Más tarde, Itkin etAl.[32] modelaron la proteína SgSQE y mostraron que la presencia del primer epóxido no impidió el acoplde de la segunda epoxidación, lo que indica que SgSQE puede sufrir una reacción de doble epoxidación.
3.2.2 Cucurbitadienol sintasa
El 2,3-epoxisqualeno está formado por protonación, ciclización, rearreglo y deprotonbajo la catálisis de diferentes tipos de oxidosqualeno ciclas(OSC), que forma el esqueleto de fitoesteroles y triterpen[73]. Por lo tanto, hay competencia entre diferentes tipos de OSC. Como miembro de la familia OSC,CDS es una ciclasclave en la síntesis de mogrósidos. Su expresión y actividad afectan el flujo metabólico de la conversión de 2,3-epoxisqualeno a mogrosido, lo que determina el rendimiento de los mogrosidos.
DaietAl.[74]identificaron SgCDS mediante la secuencide ARN (arn-seq) y el análisis Digital digitalde perfil de expresión génica (DGE) de Luo Han Guo. El cDNA es de 2.800 BP de longitud y contiene un ORF de 2.280 BP, que codifica una proteína con 759 aminoácidos con un peso molecular predicho de 84,4 kDa. La función de ciclización de SgCDS fue posteriormente verificada utilizando la cepa de levadura GIL77, que puede ciclizar 2,3-epoxisqualeno a cucurbitadienol. Dehecho, Itkin etAl.[32] usaron Saccharomyces cerevisiae y transformel tabaco Nicotiana tabacum L para analizar funcionlas SgCDS y encontraron que las SgCDS no sólo pueden ciclizar 2,3; 22,23-bisepoxisqualeno, sino también cic2,3-epoxisqualeno para producir squaleno, aunque este último no está involucrado en la síntesis de Mogroside. Otros estudios han demostrado que para el 2,3-epoxisqualeno, la ciclización de SgCDS precede a la epoxidación de ERG1, haciendo SgCDS principalmente exhila función de cicde 2,3-epoxisqualeno.
3.2.3 CYP450 y glicosiltransferasa
CYP450 es una superfamilia de genes en plantas que juegan un papel clave en la oxidde productos naturales como terpenos, flavonoides, alcaloides y lignina [75]. Con especificidad de sustrestricta y baja similitud de secuencias. Glicosiltransferasas pueden ser miembros de la segunda planta más grande de la familia de enzimas 1UGTs, que la transferencia de diferentes azúcares o azúcares a diferentes receptores, y requieren diferentes glicosiltransferasas [76]. Por lo tanto, es relativamente difícil de descubrir y clonar eficientemente los genes CYP450 y glicosiltransferasa que catalizan la biosíntesis de metaboliespecíficos. TangetAl.[77]identificaron y examinaron siete CYP450s y cinco UDPGs como genes candidatos responsables de la síntesis de M5 con base en la aplicación combinada de rna-sigsy DGE,combinada con la rápida acumulación de M5 después de 50-70 d después de la floración. Este método ha creado una manera efectiva de identificar genes candidatos responsables de la biosíntesis de nuevos metabolisecundarios en plantas no modelo.
Zhang ZhangZhangZhangZhangZhangetAl.[50] identificaron una enzima multifuncional citocromo P450 (CYP87D18) y una glicosiltransferasa (UGT74AC1) en Luo Han Guo. Ensayos de actividad enzimin vitro mostraron que CYP87D18 es responsable de catalizar la oxidde la posición C11 del furostanol para formar 11-oxofurostanol y 11-hidroxifurostanol; UGT74AC1 puede transferir específicamente glucosa a la posición C3 del loganinol para formar loganin IE. Casi al mismo tiempo, Itkin etAl.[32] identific191 CYPs y 131 UGTs en Momordica grosvenori, y preliminarmente examinaron 40 CYPs y 100 UGTs que se expresaron en los frutos en desarrollo. Se realizó verificación funcional en levadura y Escherichia coli, respectivamente. Los resultados mostraron que CYP87D18 (CYP102801) cataliza la hidroxilación de la posición C11 de trans-24,25-dihidroxicolest-4-en-3-one para producir ácido rosmólico; UGT74-345-2, UGT75-281-2, UGT720-269-1 y UGT720-269-4 son responsables de la glicosilación primaria en la posición C3, entre los cuales UGT720-269-1 es también la única enzima responsable de la glicosilación primaria en la posición C24. UGT720-269-1, UGT94-289-1, UGT94-289-2 y UGT94-289-3 son responsables de la glicosilación ramide las cadenas de glucosa C3 y C24.
3.3 biosíntesis de cucurbitadienol
LiShou-lian etAl.[78]usaron un compuesto triterpenoide obtenido en el laboratorio para expresar y fermentar heterólogamente los SGCD clonados en la cepa de chasis de levadura WD-2091 (las vías FPS,SQS,SQE y MVA fueron sobreexpresadas y reguladas), los SGCD clonados fueron expresados y fermentheter, y el rendimiento de cucurbitadienol fue de 27,44 mg/L. El gen CDS fue transferido del plásmido de alta copia pRS425 al plásmido de baja copia pRS313 para regular la expresión del gen CDS, y se obtuvo la fábrica celular 313-SL-CB Saccharomyces cerevisiae, con un aumento del 202.07% en la producción de cucurbitadienol. El rendimiento de fermentación de alta densidad alcanzó 1.724,10mg/L,que es actualmente el rendimiento más alto de síntesis microbiana de cucurbitadienol. Esta investigación ha sentado las bases para la creación de una fábrica celular eficiente para la producción de triterpenoides tetrtetrde tipo cucurbit.
La construcción de una fábrica celular microbiana para M5 puede implicar la transferencia de la vía de biosíntesis original o la reingeniería y la construcción de toda la vía metabólica. Aunque se ha demostrado que cucurbitadienol no es el esqueleto para la síntesis de loganina, la bacteria 313-SL-CB, que produce altos niveles de cucurbitadienol, se puede utilizar como una célula de chasis. El gen oxidpuede ser recombinado para convertir cucurbitadienol a 24,25-epoxicucurbitadienol, y luego catalizado por EPH,CYP450 y glicosiltransferasa para producir M5 (figura 3).
4 debate y perspectivas
Con la mejora de las personas#39;s concienciación sobre la salud, consumidores ' La búsqueda de alimentos ya no se limita a la satisfacción de sus papilas gustativas, sino que también prestan cada vez más atención a su salud y funcionalidad, lo que ha llevado a un aumento "explosivo" en la demanda de edulcorantes naturales no azucarados [30]. En particular, M5, uno de los world's edulcorantes naturales más fuertes, no sólo cumple con el público#39;s demand as a natural non-sugar sweetener, but also serves as a sucrose substitute paradiabetics and obese people due to its medicinal properties [79]. The demand paraM5 is gradually increasing worldwide [80], and plant extraction methods can no longer meetmarketdemand. Biología sintéticahas unique advantages in the eficienteand sustainable extraction of natural plant products, and has been applied to the Síntesis síntesis síntesisof various natural products [81-83]. Therefore, the large-scale production of M5 using synthetic biology is an inevitable trend. At present, the biosynthetic pathway of M5 has been completely elucidated, and the key Enzimas enzimashave been cloned and functionally verified, but research on microbial production is still lacking.
Basándonos en los principios de la biología sintética, proponemos dos estrategias para construir una fábrica celular M5: en primer lugar, como se mencionó anteriormente (figura 3), la transformación a M5 se puede lograr sobre la base de la bacteria de alto rendimiento que produce cucurbitadienol 313-SL-CB, que es la forma más conveniente; En segundo lugar, los cinco genes de enzimas que participan en la conversión de 2,3; 22,23-dioxsqualeno a M5 (Fig. 2) se pueden recombinar en células de levadura para lograr la síntesis de novo. Todavía hay muchas dificultades en la realización de la producción microbiana de moléculas activas M5 utilizando estas dos estrategias: en primer lugar, la enzima que cataliza la oxidde squaleno a 24,25-epoxisqualeno en la primera estrategia no se ha descubierto, y la segunda estrategia, la levadura#39;s endógeno ERG1, no puede proporcionar suficiente 2,3; 22,23-bisepoxisqualeno para SgCDS. En segundo lugar, la vía de biosíntesis M5 implica muchas enzimas e intermediarios, el proceso metabólico es complejo, y es difícil lograr la expresión eficiente y coordinada de genes exógenos integrados en una sola célula microbiana, lo que también causa una mayor presión metabólica sobre el huésped. Por último, SGCD,UGT720-269-1 y UGT94-289-3 son enzimas no específicas que pueden actuar sobre una variedad de sustrpara formar diferentes productos, y el orden y dirección de la catálisis en la célula del chasis son difíciles de controlar.
Para abordar los problemas, se proponen las siguientes estrategias: identificar y analizar las oxidasas que catalizan la producción de 24,25-epoxilupeol a partir de lupeol y SQEs que catalizan de manera eficiente la reacción de epoxidación; Regular más precisamente la vía aguas abajo de 2,3-epoxisqualene y 2,3-epoxisqualene es más dirigido hacia la síntesis de mogroside. En los últimos años, la ingeniería modularde co-cultivo se ha convertido en una nueva estrategia para reducir el estrés celular y aumentar la producción de productos objetivo [84-85]. Por lo tanto, la vía de biosíntesis de M5 puede ser razonablemente dividida en diferentes módulos, y cada módulo puede ser integrado en una cepa específica. Las cepas reclutadas se pueden integrar en un solo espacio, y luego co-cultivar las cepas reclutadas para lograr la síntesis de novo de M5. La biología estructural se utiliza para analizar la estructura de las proteínas de la enzima y entender el mecanismo catalítico específico, y la especificidad de sustrde la farnesiltransferasa y glicosiltransferasa se mejora a través de la modificación enzimadecuada. Se desarrollan tecnologías de monitorización en tiempo real y regulación metabólica dinámica para conseguir catálisis dirigida de enzimas. Con el desarrollo de la biología sintética y la ingeniería metabólica, la producción de bajo costo, a gran escala de M5 seguramente se realizará.
Referencia:
[1] Suez J, Korem T, Zeevi D, et Al. Edulcorantes artificiales induce glucose intolerancia por Alterar el El intestino Microbiota. Naturaleza, 2014, 514(7521): 181 — 186.
[2] Kokotou MG, Asimakopoulos AG, Thomaidis NS. Artificial Artificial Artificial sweeteners as Contaminantes emergentes En el medio ambiente: Analítico analítico metodologías Y medio ambiente Impacto. Anal Methods, 2012, 4(10): 3057-3070.
[3] Gupta P, Gupta N, Pawar AP, et Al. Papel Azúcar y sugar sustitusustitutos in dental Caries: a Revisión. ISRN Dent, 2013, 2013: 519421.
[4] Bray GA, Popkin BM. Dieta dieta sugar and Peso corporal: ¿Hemos llegado a una crisis en la epidemia de obesidad and Diabetes? : Salud salud be ¡Maldita sea! Por el Sobre el azúcar. Diabetes Care, 2014,37(4): 950-956.
[5] YangQH,Zhang ZF, Gregg EW,etAl.Consumo de azúcar añadido y mortalidad por enfermedades cardiovasculares en Estados Unidos Adultos. JAMA interno Med, 2014, 174(4): 516-524.
[6] Wiader K,Wegner K,Piotrowska A,etAl.Las plantas como un source of natural Alta intensidad Edulcorantes: Una revisión. JAppl Bot La comidaQual, 2019, 92: 160-171.
[7] Kroger M, En Meister K, Kava R. Edulcorantes bajos en calorías y otros sustitutos del azúcar: revisión del safety Temas. Compr Rev La comida Sci La comida Saf, 2006, 5(2): 35-47.
[8] Jin ML, Muguruma M, Moto M, et Al. Trece semanas repetido dose Toxicidad toxicidad of Siraitiagrosvenori Extractos extractos extractos in Wistar Hannover (GALAS) rats. La comidaMaterias químicasToxicol, 2007, 45(7): 1231-1237.
[9] Kinghorn AD, Kaneda N, Baek NI, et Al. Edulcorantes naturales intensos no cariogénicos. Med ResRev, 1998, 18(5): 347-360.
[10] Adeogun O, Adekunle A, Ashafa A. Composición química, lethality and antifúnantiantifún actividades of the Extractos extractos extractos of hoja of Thaumatococcus Abogado general Transmitida por los alimentos Hongos. Beni-Suef Univ J Basic Appl Sci, 2016, 5(4): 356-368.
[11] Goyal SK, Samsher, Goyal RK. Stevia (Stevia rebaudiana) Un bio-edulcor: a Revisión. En el J Food SciNutr, 2010,61(1): 1-10.
[12] Singh DP, Kumari M, Prakash HG, et Al. Fitoquímicos and pharmacological importancia Stevia: un edulcornatural sin calorías. Sugar Tech, 2019, 21(2): 227-234.
[13] Jin J,LeeJH. Aspectos fitoquímicos y farmacológicos de Siraitia grosvenorii, luo han Kuo. Orient Pharm Exp Med, 2012, 12(4): 233-239.
[14] Zhang XB, Canción canción YF, En Ding YP, et Al. efectos Fabricación en la cual: on Inducida por la alta cantidad de grasa en la dieta Obesidad obesidad Y enfermedad hepática grasa no alcohólica en ratones. Moléculas, 2018, 23(8): 1894.
[15] Mizutani K,Kuramoto T,Tamura Y,etAl.Dulzor del ácido glicirreético 3-O- − -d-monoglucuroniy los glucósidos relacionados. Biosci Biotechnol Biochem, 1994, 58(3): 554-555.
[16] Isbrucker RA, embarembar GA. riesgo and Evaluación de la seguridad on the consumption of licoarroz Raíz (Glycyrrhiza Sp.), su extracto y polvo como ingrediente alimenticio, con énfasis en la farmacología y toxicología of Glycyrrhizin. Regul Toxicol Pharmacol, 2006, 46(3): 167-192.
[17] DuBois GE, Prakash i.non-calórico Edulcorantes, dulzura Moduladores, and sweetener Potenciadores. Annu RevFood SciTechnol, 2012, 3: 353-380.
[18] Williamson EM,Liu:XM,Izzo AA. Tendencias en el uso, farmacología y aplicaciones clínicas de los nutracéuticos herbemergentes. Br JPharmacol, 2020,177(6): 1227-1240.
[19] Matsumoto K, Kasai R, Ohtani K, et Al. menor cucurbitanglucósi. desde frutas of Siraitia Grosvenori (Cucurbitaceae). Chem Pharm Bull, 1990, 38(7): 2030-2032.
[20] Liu: T, Wang WangWangWangWangWangWang XH, Li C, et Al. estudio on The antitussive, expectorant and antispasmodic effects of saponin V desdeMomordica grosvenori (en inglés). Chin Pharm J,2007, 42(20): 1534-1536, 1590.
[21] Liu: C, Dai LH, desde DQ, et Al. A natural Edulcorantes para alimentos with Antipancreo (antipancreo). cancer Propiedades. Oncogénesis, 2016, 5(4): e217.
[22] Takasaki M, Konoshima T, Murata Y, et Al. anticancinogé. actividad of natural Edulcorantes, Glucóside cucurbitano, de Momordica Grosvenori.Cáncer Lett, 2003, 198(1): 37-42.
[23] Chen WJ, Wang J, Qi XY, et Al. The Actividad antioxidante Fabricación natural Edulcorantes, Mogrósidos, De frutas De Siraitia Grosvenori. En el J Food Sci Nutr, 2007, 58(7): 548-556.
[24] ZhouY,Zheng Y, Ebersole J,etAl.Efectos estimulantes de mogroside V y extracto de fruta de Luo Han Kuo (Siraitia grosvenori Swingle) extracto de fruta. Acta Pharm Sin, 2009, 44(11): 1252-1257.
[25] Tu DQ, Ma XJ, Zhao H, et Al. clonación and Expresión de SgCYP450-4 de Siraitia grosvenorii.Acta Pharm Sin B, 2016, 6(6): 614-622.
[26] Makapugay HC, Nanayakkara NPD, Soejarto DD, et al. Alto rendimiento Líquido líquido líquido líquido líquido líquido líquido líquido líquido líquido líquido líquido líquido Análisis cromatográfico del principio dulce principal a los frutos de LoHan Kuo. JAgric Food Chem,1985, 33(3): 348-350.
[27] Rao SR, Ravishankar GA. La planta célula Cultivos: químicos Las fábricas of Secundaria secundaria Metabolitos. Biotechnol Adv, 2002, 20(2): 101-153.
[28] Dudareva N, DellaPenna D. La planta Ingeniería metabólica: futuro Las perspectivas and Retos. CurrEx exBiotechnol,2013, 24(2): 226-228.
[29] Smanski MJ, Zhou H, Claesen J, et Al. Synthetic biology to acceso and ampliar La naturaleza Diversidad química. NatRev Microbiol,2016, 14(3): 135-149.
[30] Philippe Philippe RN, De Mey M, Anderson Anderson Anderson J, et Al. Producción biotecnológica de edulcorantes naturales sin calorías. Curr Ex ex Biotechnol, 2014, 26: 155-161.
[31] Cameron DE, Bashor CJ, Collins JJ. Una breve historia de synthetic Biología. Nat Rev Microbiol, 2014, 12(5): 381-390.
[32] Itkin M, Davidovich-Rikanati R,Cohen S, et Al.La vía biosintética del edulcorde de alta intensidad sin azúcar mogroside V desde Siraitia Grosvenorii. Proc Natl Acad Sci EE.UU., 2016, 113(47): E7619-E7628.
[33] Li DP, Zhang HR. estudios and usos of Chino chinomedicine Luohanguo-a especial local product De Guangxi. Guiá, 2000, 20(3): 270-276.
[34] Lee CH. intenso sweetener desde Lo Han Kuo (Momordica grosvenori). Experientia, 1975, 31(5): 533-534.
[35] Kasai R,Nie RL,Nashi K, et al. Glucóside de cucurbitano dulce desde fruits Siraitia siamensis (chi-zi luo-han-guo), a Chinese Medicina popular. Agric BiolChem,1989, 53(12): 3347-3349.
[36] Ukiya M, Akihisa T, tokude H, et al. Efectos inhibide los glicósidos de cucurbitano y otros triterpenoides de la fruta de Momordica grosvenori en Epstein-Barr Virus virus early antigen induced by Tumor tumor Promotor 12-o-tetradecanoilforbol-13-ace. JAgric Food Chem, 2002, 50(23): 6710-6715.
[37] Wang L,LiLC, Fu YX, et al. Separación, síntesis y citotoxicidad de una serie de derivados del mogrol. JAsian Nat Prod Res, 2019: 1-15.
[38] Murata Y, Yoshikawa S, SuzukiYA,et al. Características de dulzor of the triterpene glycosides in Siraitia grosvenori. J Jpn Soc Food Sci Technol, 2006, 53(10): 527-533.
[39] Takemoto T,Arihara S, Nakajima T, et al. Estudios sobre la Componentes componentes De fructus Momordicae. Yo. el El dulce Principio. Yakugaku Zasshi, 1983, 103(11): 1151-1154.
[40] Takemoto T, Arihara S, Nakajima T, et al. Estudios sobre los constituyentes de fructusMomordicae.II. Estructura de Sapogenin. Yakugaku Zasshi, 1983, 103(11): 1155-1166.
[41] Takemoto T, Arihara S, Nakajima T, et al. Estudios sobre la Componentes componentes of fructus momordicae. III. estructura of Mogrósidos. Yakugaku Zasshi, 1983, 103(11): 1167-1173.
[42] LiDP, Ikeda T, Huang YL, et al. Variación estacional de los mogrosidos en los frutos de Lo Han Kuo (Siraitia grosvenori). J Nat Med, 2007, 61(3): 307-312.
[43] Itkin M, Heinig U, Tzfadia O,et al. Biosíntesis de antinutricional alcaloides in solanáceas cultivos is mediated por agrupen Genes. Ciencia, 2013, 341(6142): 175-179.
[44] Harrison Harrison DM. The biosíntesis of Triterpenoides, esteroides y carotenoides. Nat Prod Rep, 1990, 7(6): 459-484.
[45] Lange BM, Ahkami A. Metabolismo metabólico ingeniería fabricación Monoterpenos, sesquiterpenes Y diterpenes-corriente Estado de la situación and futuro Oportunidades. La plantaBiotechnol J, 2013, 11(2): 169-196.
[46] Bouvier F, Rahier A, cámara B. Biogénesis, molecular reglamento and función of Planta isoprenoides. Prog Lipid Res, 2005, 44(6): 357-429.
[47] Liao P, Hemmerlin A, Bach TJ, et al. El potencial de la vía del mevalonato para mejorar la producción de isoprenoides. Biotechnol Adv, 2016, 34(5): 697-713.
[48] Laule O, Furholz A, Chang HS, et al. Crosstalk between (en inglés) citosó and plastiplastiplasto Caminos caminos De isoprenoide biosíntesis in Arabidopsis Thaliana. Proc Natl Acad Sci USA, 2003, 100(11): 6866-6871.
[49] Shibuya M, Adachi S, Ebizuka Y. Cucurbitadienol sintasa, La primera enzima comprometida para la biosíntesis de cucurbitacina, es una enzima distinta del cicloartenol sintasa para fitofitofito Biosíntesis. Tetraedro, 2004, 60(33): 6995-7003.
[50] Zhang JS, Dai LH, Yang JG, et al. oxidoxidoxidoxidoxid De cucurbitadienol catcat por CYP87D18 in The biosíntesisof mogrósidosdesdeSiraitia grosvenorii (en inglés). Plant célulaFisiol,2016, 57(5): 1000-1007.
[51] Lee JH, Weickmann JL, Koduri RK, et expresión of synthetic thaumo genes in Levadura. Biochemistry, 1988, 27(14): 5101-5107.
[52] Daniell S, Mellits KH,Faus I, et al. Volviendo a plegel dulce protein thaumo II desde Exclusión insoluble cuerpos synthesised in Escherichia Coli. Food Chem, 2000, 71(1): 105-110.
[53] Masuda T, Kitabatake N. Evolución evolución in biotechnological production of Dulce dulce Proteínas. J Biosci Bioeng, 2006, 102(5): 375-389.
[54] Ceunen S, Geuns JMC. Glucósidos de esteviol: diversidad química, Metabolismo, and Función. J Nat Prod, 2013, 76(6): 1201-1228.
[55] Wang JF, Li SY, Xiong Xiong ZQ, et al. Integración de partes de enzimas críticas para la biosíntesis de novo de steviolglycosides dulzante en Escherichia coli. Cell Res, 2016, 26(2): 258-261.
[56] Olsson K, Carlsen S, Semmler A, et al. Producción microbiana of Próxima generación stevia Edulcorantes. Microb Cell Fact, 2016, 15: 207.
[57] Xu GJ, i W, Gao W, et al. A glucuronosyltransferase has an Una capacidad sin precedentes to catalyse continuas Glucuronosilación de dos pasos of glycyrrhetinic Ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido to Ringlycyrrhizin. New Phytol, 2016, 212(1): 123-135.
[58] Li C, Zhao YJ, El Feng XD, et al. aplicación De glicosil transferasa in glycyrrhizic Ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido Síntesis: CN, 110106222. 2019-08-09.
[59] Liu:JD, Zhang WP, Du GC, et al. Sobreproducción de geraniol by mejorado precursor suministro En Saccharomyces Cerevisiae. J Biotechnol, 2013, 168(4): 446-451.
[60] Agustín JM, Kuzina V, Andersen SB, et Al. Molecular Actividades, biosíntesis and Evolución evolución triterpenoide Saponinas. Phytochemistry, 2011, 72(6): 435-457.
[61] Guo HH, Li RF, Liu: SB, et al. Caracterización Molecular, Expresión, and reglamento Gynostemma pentaphyllum Squalene epoxidasegene
1. Plant Physiol Biochem, 2016, 109: 230-239.
[62] Rasbery JM, Shan H,LeClair RJ, et al. Arabidopsis thaliana squalene epoxidasa 1 is esencial Para el desarrollo de raíces y semillas. J BiolChem, 2007, 282(23): 17002-17013.
[63] Yu Y, Chang PC, Yu H, et al. productiva Amyrin synthases (en inglés) for efficient − -amirin Síntesis síntesis síntesis in engineered Saccharomyces Cerevisiae. ACS Synth Biol,2018, 7(10): 2391-2402.
[64] Wang ZH, Yeats T, Han H, et al. clonación Caracterización y caracterización of oxidosqualeno ciclases De Kalanchoe daigremontiana: enzymes hasta 10 rearreglo Los pasos El rendimiento friedelin otras Triterpenoides. J Biol Chem, 2010, 285(39): 29703-29712.
[65] Yao Z, Zhou PP, Su BM, et al. Mejora la producción de isopreno by reconstrucción Metabolismo metabolismo metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica metabólica Equilibrio entre fortaleci precursor suministro Y mejorado isopreno sintasa in Saccharomyces Cerevisiae.ACS Synth Biol, 2018, 7(9): 2308-2316.
[66] La regeneración de NADPH acoplcon la actividad de HMG-CoA reductasa aumenta el squalene synthesis in Saccharomyces cerevisiae. J Agric Food Chem, 2017, 65(37): 8162-8170.
[67] Ro DK, Paradise EM, Ouellet M, et al. Producción del precursor del fármaco antimaláriácido artemisínico en levadura artificial. Nature, 2006, 440(7086): 940-943.
[68] Nelson JA, Steckbeck SR, Spencer TA. Biosíntesis de 24, 25-epoxicolesterol desde Squalene 2,3;22, 23-dióxido. J Biol Chem, 1981, 256(3): 1067-1068.
[69] Boutaud O, Dolis DH, Schuber F. Ciclación preferencial of 2,3(S):22(S),23-dioxidosqualene Por mamíferos 2,3-oxidosqualene-lanosterol ciclas. Biochem Biophys Res Común, 1992, 188(2): 898-904.
[70] Godio RP, La foufou R, Martin Martin JF. A squalene epoxidase is involved in biosynthesis De ambos El compuesto antitumoral ácido claváriy esteroles en el basidiomicetes H. Sublateritium. Chem Biol, 2007, 14(12): 1334-1346.
[71] Suzuki H, acnueve L, Xu R, et al. A Enfoque de la genómica to the early stages De triterpene Biosíntesis de saponina en Medicago truncatula. Planta J, 2002, 32(6): 1033-1048.
[72] Zhao H, Guo J, Tang Q, et al. clonación Y expresión analysis of squalene epoxidase Genes de Siraitia grosvenorii. China J Chin Mater Med, 2018, 43(16): 3255-3262
[73] Wu Wu TK, Chang CH, Liu YT, et Al. Saccharomyces cerevisiae oxidosqualene-lanosterol Ciclasa: A chemistry-biology (en inglés) interdisciplininterdisciplininterdisciplin estudio of La proteína proteína Structure-function-reaction (en inglés) Relaciones de mecanismo. Chem Rec, 2008, 8(5): 302-325.
[74] Dai LH, Liu C, Zhu Mi, et al. Caracterización funcional of cucurbitadienol synthase Y triterpenos glucosiltransferasa involved En biosíntesis of mogrosides from Siraitia grosvenorii. Plant Cell Physiol, 2015, 56(6): 1172-1182.
[75] Han JY, Kim Kim Kim HJ, Kwon YS, et al. The Cyt Enzima P450 CYP716A47 catcat the formación Protopanaxadiol de dammarenediol-II durante ginsenósido biosynthesis in Panax Ginseng. Plant Cell Physiol, 2011, 52(12): 2062-2073.
[76] Caputi L, Malnoy M, Goremykin V, et al. A genome-wide phylogenetic reconstruction of Family (en inglés)
1 udp-glicosiltransferasas reveló la expansión de la familia durante la adaptación de las plantas a la vida en la tierra. Planta J, 2012, 69(6): 1030-1042.
[77] Tang Q, Ma XJ, Mo CM, et al. Un enfoque eficaz finding Siraitia grosvenorii triterpenbiosintético genes by RNA-seq and digital Análisis de expresión génica. BMC Genomics, 2011, 12: 343.
[78] Li SL, Wang D, Liu Y, et al. Estudio de la síntesis eficiente heteróloga de cucurbitadienol. China J Chin Mater Med, 2017, 42(17): 3326-3331.
[79] Xia Y, riverhuguet Yo, Hughes BH, et Al. Aislamiento of the Dulce dulce Componentes componentes from Siraitia grosvenorii. Food Chem, 2008, 107(3): 1022-1028.
[80] Wang L, Yang ZM, Lu ( et al. Glucóside de cucurbitano Derivado del derivado from mogroside IIE: structure-taste (en inglés) Relaciones, antioxidante Actividad, y Aguda aguda Toxicidad. Moléculas, 2014, 19(8): 12676-12689.
[81] Liu LQ, Liu H, Zhang W, et al. ingeniería La biosíntesis of caffeic acid in Saccharomyces cerevisiae con combinaciones de enzimas heterólogas. Ingeniería, 2019, 5(2): 287-295.
[82] Srinivasan P, Fabricación a partir de CD. Ingeniería Una biosíntesis microbiana Plataforma plataforma for de novo production Of tropano alkaloids (en inglés). Nat Commun, 2019, 10: 3634.
[83] Chen HF, Zhu CY, Zhu MZ, et al. Alta producción de valencene in Saccharomyces cerevisiae A través de ingeniería metabólica. Hecho de células Microb, 2019, 18: 195.
[84] Wang RF, Zhao SJ, Wang ZT, et al. Recent advances in modular co-cultura ingeniería for synthesis Fabricación natural Productos. Curr Opin Biotechnol, 2020, 62: 65-71.
[85] Li ZH, Wang XN, Zhang HR. Equilibrio equilibrio equilibrio The non-linear rosmarinic acid biosynthetic pathway by modular (en inglés) co-cultura Ingeniería. Metab Eng, 2019, 54: 1-11.


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




