¿Cómo preparar la Stachyose?
Elintestino humano es un ecosistema microbiano complejo. Hay más de 1.000 especies de bacterias, y el equilibrio ecológico entre las bacterias beneficiosas y dañinas afecta directamente la salud del huésped [1-2]. El consenso científico sobre probióticos (edición de 2020)[3] afirma que los probióticos pueden mejorar la salud intestinal humana mediante la regulación de la proporción de la flora en el intestino.
El "alimento" De los probióticos se llama prebióticos, que es un nutriente ampliamente reconocido con la función de promover el crecimiento de bacterias intestinales beneficipara formar una estructura de colonia favorable [4-6], y el concepto de prebióticos fue propuesto por primera vez por Giboson y Robefroid en 1995 [7], y el concepto de probióticos fue propuesto por primera vez por Giboson y Robefroid en 1995 [8]. El concepto de prebióticos fue propuesto por primera vez por Giboson y Robefroid en 1995 [7], y los prebióticos comunes incluyen oligofructosa, oligosacárido de soja, oligosacáridos, oligosacáridos, oligosacáridos, oligoisomaltosa, oligogalactosa, y fructooligosacáridos [8]. En comparación con los prebióticos comunes, la fructosa puede promover más eficazmente la proliferación de bacterias beneficiosas como Bifidobacterium intestinalis [9], que se conoce como el "súper factor bifidogénico", y es una materia prima popular para los alimentos funcionales intestinales en los últimos años [10].
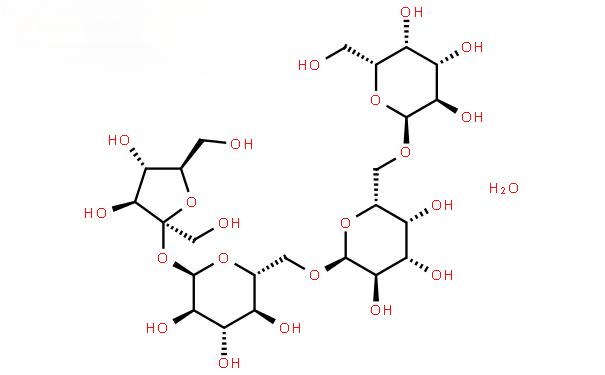
Fabricación en la cual:Es un tetrasacárido de origen natural, perteneciente ala clase galactósido de glucóside de semilla de algodón, un oligosacárido funcional no reduc[11-12], que es un polvo blanco en forma pura, ligeramente dulce, con una dulzura del 22% de la de la sacarosa [13]. La fórmula molecular de la fructosa es C24H42O21, y la estructura molecular es galactosa-galactosa-glucosa-fructosa (como se muestra en la figura 1), que es un miembro típico de la familia de oligosacáridos de la semilla de cott[14-15] (como se muestra en la figura 2), y que existe principalmente en las plantas del género Fructus de la familia Labiatae. En los últimos años, las funciones fisiológicas de la fructosa se han explorado continuamente, y las funciones reportadas hasta ahora incluyen: inmunomodulación, mejora de la defecación, prevención de la lesión hepática química, síntesis de vitaminas B, promoción de la absorción intestinal de oligoelementos, prevención de la diabetes mellitus, etc [16-21]. La sacarosa es ampliamente utilizada en productos farmacéuticos, alimentos, cosméticos y otros campos [22].
La creciente demanda de los mercados nacionales y extranjeros tiene una amplia perspectiva de aplicación, pero la falta de métodos de producción eficientes ha llevado al alto costo de treonine de alta pureza, lo que limita el desarrollo de su aplicación, por lo tanto, es de gran importancia para explorar un método rápido, eficiente y de bajo costo para producir treonine de alta pureza.
La preparación dePolvo de estamiosa Se divide principalmente en dos etapas: extracción y purificación. Basado en el desarrollo actual del proceso de preparación de la fructosa, este trabajo revisa el progreso de la investigación en la extracción y purificación de la fructosa, y discute las ventajas y desventajas de los diferentes procesos de preparación, con el fin de proporcionar referencias para el trabajo de investigación relacionado con la producción industrial de fructosa.
1 visión general de la preparación de la estaquiosa
En los últimos años, hay más de mil resultados de investigaciones sobre el proceso de preparación de la fructosa, que implican diferentes materias primas, métodos y efectos de extracción. En la actualidad, entre los más de 10 tipos de oligosacáridos en el mercado internacional, a excepción de los oligosacáridos de soja y los azúcares de las semillas de algodón, el resto de los oligosacáridos se preparan principalmente enzimáticamente [23], debido a que el costo de la preparación enzimde la fructosa es mayor, y el rendimiento es menor [24], por lo que la extracción de fructosa de plantas naturales es la principal de la preparación de la fructosa, que es más adecuada para la producción industrializada. Las materias primas vegetales que se pueden utilizar como la extracción de fructosa incluyen: Dioscorea, Salvia miltiorrhiza, Ginkgo biloba (también conocido como el stoneworm herbá), Zeran, soja, etc. [25-27]. El flujo de proceso de la preparación tradicional de fructosa se muestra en la figura 3.
Como se muestra en la figura 3, el proceso de preparación tradicional es extraer los materiales de la planta a través de maceración, decoloración, desalación, secado y otras operaciones para obtener el extracto de fructosa, en base a la cual, los investigadores combincon las tecnologías biológicas, físicas, químicas y otras para optimizar aún más las condiciones experimentales, con el fin de mejorar la pureza de la fructosa. Los procesos comunes de extracción de fructosa se dividen en tres tipos principales: extracción de solución, fermentación microbiana y extracción enzim, y los métodos comunes de purificación incluyen separación de membrana, cromatode columna de purificación y cristalización.
Recientemente, Gerliani et al [28] encontraron que en la extracción de proteínas, carbohidratos solubles y minerales de harina de soja mediante el uso de electroactivación en combinación con soluciones fitoquímicas, una cierta cantidad de fructosa y azúcares de malváscaros estaban presentes en las muestras de analiy catobtenido, y su contenido aumentó con el voltadel ánodo dentro de un cierto rango de volta, hasta 222,49 mg/g y 34,29 mg/g, respectivamente. Los hallazgos de este experimento pueden proporcionar una nueva dirección técnica para la extracción de fructosa.
2 progreso del proceso de extracción del polvo de estaquiosa
Método de extracción con solución 2.1
Solvent extraction is the most traditional method of extraction and is commonly used to extract active ingredients from natural plants. Based on the principle of similarity and solubility, the solvent with the highest solubility for the extract is chosen to extract it from the solvent with the lowest solubility. The solvents commonly used for the extraction of fructose are water and ethanol. Depending on the purpose of the study, the appropriate extracting solution, raw material, and extraction process should be selected.
2.1.1 método de extracción única
Cuando se utiliza agua como disolvente de extracción, el coste de extracción es bajo y la penetración de agua en las células de las plantas es fuerte. Zhang Min et al [29] utilizaron agua desionizada como disolvente para extraer la fructosa de Radix et Rhizoma Dioscoreae, y las mejores condiciones de extracción se investigaron mediante pruebas unidireccional y ortogonales, y las mejores condiciones de extracción se encontraron a una temperatura de extracción de 50 °C, con una relación material líquido de 1:12 (kg/L), y un tiempo de extracción de 60 Min, resultando en una tasa de extracción de 58,84% de fructosa. Más investigadores optpor utilizar el saltamontes como materia prima, debido al alto contenido de fructosa en el saltamontes [30], y su textura quebradiza, alto contenido de agua de las características de la textura, Yao Hong et al. La tasa final de extracción de fructosa alcanzó el 91,62%. Después de la purificación de varios pasos,96.10% purity of fructose powder was obtained. The study of high purity and low cost of fructose extraction is expected to provide a reference for the industrial preparation of high-purity fructose, but when water is used as the extracting solution, the water is prone to mildew and deterioration, and it is not easy to be preserved.
Cuando se utiliza etanol como extractante, tiene las ventajas de una fuerte permeabilidad y un período de conservación más largo en comparación con el extracto de agua, pero diferentes concentraciones de etanol tienen un mayor impacto en los componentes extraídos. Zhong et al [32] utilizaron la metodología de superficie de respuesta para investigar la influencia de diferentes factores en la extracción de fructosa en las barras de plata, y los resultados finales mostraron que la influencia del tamaño de la relación material-líquido > Relación volumen de etanol > Temperatura de extracción > Tiempo de extracción, por lo que la clave para utilizar etanol como un extractante es explorar y controlar la concentración óptima de extracción de etanol. Los resultados finales mostraron que la influencia de la relación material-líquido > Relación volumen de etanol > Temperatura de extracción > Tiempo de extracción, por lo que la clave para utilizar etanol como solución de extracción es explorar y controlar la concentración óptima de extracción de etanol.

2.1.2 métodos de extracción auxiliar
El método de extracción con agua o alcohol no es eficiente y tiene muchas impurezas, por lo que suele ser necesario combinarlo con algunas técnicas auxiliares. La extracción asistida se refiere al método de extracción de la solución a través de técnicas físicas o biológicas, tales como ultrasónicas, microondas, ultraalta presión y otras técnicas asistidas. Las técnicas asistidas se basan en un único método de extracción, asistido en la lixiviación de los extractos, seguido de centrifu, remode las impurezas sobrennatantes y pasos de refin, similar al proceso mostrado en la Fig. 3, y la operación específica se basa en la naturaleza de las impurezas realmente producidas. El uso de técnicas de extracción asistida puede mejorar significativamente el flujo de ingredientes activos de la planta [33-35].
Extracción asistida por ultrasonidos es en realidad el uso de ultrasonido con efecto cavitación, efecto mecánico y efecto térmico, acelerar la velocidad del movimiento molecular y aumentar la penetración del medio, para acelerar la disolución de los principios activos [36]. Wang Qi-Wei et al [37] utilizaron el método de extracción con agua asistida por ultrasonidos para extraer la fructosa en el gusande hierba, los resultados muestran que el efecto sobre la tasa de extracción en orden descendente es el tiempo de extracción > Potencia ultrasónica > Temperatura de extracción; Hu Binjie et al [38] encontraron que, en la tecnología ultrasónica asistida, el tiempo de extracción del método de extracción de agua puede ser acortado en 3/4, y la tasa de extracción de polisacáridos para aumentar en un 300%. Sin embargo, la tecnología ultrasónica necesita controlar el tiempo ultrasónico, demasiado tiempo va a destruir la estructura de los polisacáridos, por lo que la cadena de azúcar se rompe, lo que resulta en una reducción en la tasa de extracción.
El principio de la extracción asistida por microondas es utilizar las sustancias polares dentro de la célula para absorber y convertir la energía de microondas en energía térmica, de modo que la temperatura intracelular se eleva rápidamente, el agua se vaporiza y la presión intracelular aumenta, rompiasí la membrana celular y la pared celular para formar grietas o poros, y luego acelerar la entrada del agente de extracción desde el exterior de la célula para disolver las sustancias eficaces y luego fluir fuera de la célula. Chen Chuanyun et al. [39] inventaron un método de extracción asistida por microondas para la fructosa, y obtuvieron 15 kg de fructosa de 50 kg de Bombyx mori fresca, con una pureza de 90,02%, que se caracteripor un corto tiempo de extracción y alta eficiencia. Este método se caracteriza por un corto tiempo de extracción y alta eficiencia. La premisa del método asistido por microondas es que el material tratado debe tener una buena absorción de agua y el producto debe tener una buena estabilidad térmica.
UHP-assisted extraction of bioactive components from natural plantsEs una tecnología emergente. Esta técnica puede acelerar eficazmente la velocidad de transferencia de masa, romper las células de la planta para aumentar la velocidad de extracción, acortar el tiempo de procesamiento y reducir el consumo de disolvente. Wu et al [40] utilizaron la extracción asistida a alta presión para extraer polisacáridos y β -glucanos del micelio de aspergilmiceli, y el extracto tratado a alta presión tenía un mayor contenido de polisacáridos y una actividad más fuerte en comparación con la del extracto empapado en agitación convencional.
El método asistido por explosión de vapor es el uso del método de alivio de presión instantánea de alta temperatura y alta presión, de modo que la energía interna de las moléculas de vapor penetren en el tejido vegetal en energía mecánica, destruyendo las capas celulares de tejidos de biomasa, acelerando así el flujo de salida del contenido celular [41]. Similar al método asistido por microondas, ambos métodos utilizan el cambio de presión física para promover la disolución de extractos, evitando la contaminación secundaria causada por el tratamiento químico, y se caracterizan por bajo costo y no contaminación.
Hong Feng et al [41] utilizaron la tecnología de explosión de vapor para extraer xilooligosacáridos de maíz Stover, la prueba mostró que los azúcares en el líquido de explosión de vapor son principalmente oligosacáridos y algunos polisacáridos solubles, en la presión de vapor de 1,60 MPa y 2,00 MPa bajo la presión dimensional durante 5 min, el rendimiento final de los oligosacáridos de 36,00% a 59,00%. Este método no se utiliza actualmente en la preparación de fructosa, pero la estructura y la función de los xilooligosacáridos y la fructosa son similares, comparables, y la fructosa es térmicamente estable, método de explosión de vapor puede convertirse en una nueva forma de ayudar a la extracción de fructosa.
2.2 fermentación microbiana
La fermentación microbiana es actualmente el método más económico para purila fructosa, y en los últimos años han seguido surgiendo estudios sobre la preparación de la fructosa por fermentación microbiana. La fermentación microbiana utiliza microorganismos para consumir selectivamente ciertos azúcares como fuente de reproducción metabólica, que se caracteriza por el consumo preferencial deOligosacáridos no funcionalesMejorando así la pureza de los oligosacáridos funcionales del ingrediente objetivo. La clave de la fermentación microbiana es controlar los factores que afectan el crecimiento y el metabolismo de los microorganismos [42], tales como el tipo y el número de microorganismos (puros o mixtos), la actividad enzim, y el ambiente de fermentación (temperatura, oxígeno, pH, etc.).
2.2.1 tipos y número de microorganismos
El estudio y el análisis de las características de fermentación de determinados microorganismos y su utilización racional pueden mejorar eficazmente la pureza de los productos objetivo [43]. Wang Zhirong [44] investigó el efecto de la fermentación de Lactobacillus, tres tipos de levaduras, Aspergillus oryzae y Fusarium. Los resultados mostraron que Aspergillus oryzae y Saccharomyces cerevisiae eran adecuados para la fermentación y purificación de fructosa, y Saccharomyces cerevisiae tuvo el mejor efecto: la tasa de retención de fructosa por Saccharomyces cerevisiae después de 48 h de fermentación fue del 93.31%, lo que representó el 87.04% del contenido total de azúcar. Shu Danyang et al. [45] registraron la degradación de mono y disacáridos y fructosa en Aspergillus niger, Aspergillus oryzae, Lactobacillus casei, Lactobacillus swissii, y Lactobacillus rhamnosus por cinco cepas para proporcionar una referencia para la selección de microorganismos en el campo de la fermentación microbiana para la preparación de fructosa.
En la industria de alimentos fermentados y enzimas, el efecto de la fermentación mixta es mejor que la fermentación pura [46]. La fermentación mixta tiene las ventajas de la simbiosis multibacteriana, la complementde enzimas y el refuerzo mutuo, y puede superar el problema de la gran concentración de productos intermedios puros de fermentación. La aplicación de la tecnología de fermentación mixta para la purificación de la fructosa puede mejorar eficazmente la eficiencia de la purificación de la fructosa.
Wang Xue et al [47] utilizaron la fermentación de las bacterias mixtas Aspergillus japonicus y Lactobacillus para purificar la fructosa de las barras de plata, los resultados mostraron que después de la fermentación de las bacterias mixtas, los componentes de sacarosa y monosacáridos en el extracto se redujeron en comparación con la fermentación pura, la cantidad total de sacarosa y monosacáridos se redujo a 3,00%, y la tasa de retención de fructosa fue más de 95,00%, lo que representó el 90,00% del contenido total de azúcar, Que se combincon la cromatoindustrial para puriaún más la fructosa, y finalmente obtuvo la pureza de la fructosa. Combinado con la técnica de separación cromatográfica industrial, la pureza de fructosa era 90.00%~95.00% (del azúcar total), y este método ha sido aplicado por muchas empresas famosas en China.
Actividad enzimática
Las enzimas son uno de los factores importantes que afectan a la fermentación microbiana, y los inhibidores enzimque promueven el consumo de mono y disacárido o inhila la degradación de la fructosa se pueden añadir para mejorar rápidamente la pureza de la fructosa y acortar el tiempo de extracción. Zhou et al. [48] investigaron los efectos de dos inhibidores de la sucrasa, la sal dissodio de ácido etilendiaminotetraacético (EDTA-2Na) y el ácido ascórbico/vitamina C (VC), en la purificación de la fructosa en la fermentación de Aspergillus niger con el uso del gusano de seda Pseudomonas sylvestris como materia prima. El efecto de dos inhibidores de la sucrasa, a saber, la fermentación de Aspergillus niger y el ácido ascórbico/vitamina C, sobre la purificación de la fructosa. Los resultados mostraron que la adición de una cantidad adecuada de inhibidores de la sucrasa podría reducir efectivamente la probabilidad de degradación de la sucrasa de A. niger durante el proceso de fermentación, y por lo tanto aumentar el contenido de A. niger. La cantidad óptima de EDTA-2Na fue 0.01% de la masa del líquido extraído, y la pureza de fructosa fue 80.43% bajo las condiciones óptimas de prueba.
2.2.3 ambiente de fermentación
Durante el crecimiento y metabolismo de los microorganismos, los nutrientes y la energía proporcionados por el ambiente de fermentación afectan directamente a la eficiencia de la biosíntesis y la calidad de los productos objetivo, por lo que es necesario investigar las condiciones óptimas de cultivo para las cepas seleccionadas.
En el estudio de Xie Jin[49], las condiciones que afectan a la fermentación microbiana se investigaron más ampliamente. En este estudio, el 0.01% de Aspergillus niger y el 0.01% de Lactobacillus casei se utilizaron como la combinación óptima de fermentación y fermentación.
Los resultados mostraron que la tasa de retención de fructosa en el grupo de fermentación sincronizada fue 10,12% mayor que la del grupo de fermentación retardada después de 36 h de fermentación, lo que se debe a que hay un efecto sinérgico entre los microorganismos, y la fermentación sincronizada es más beneficiosa para la mejora de la pureza de la fructosa en el extracto que la fermentación retardada. El valor pH del caldo fermentvarió de 5,5 a 7,0, lo que fue favorable para frenar la degradación de sassafras sin afectar el consumo de sacarosa por parte de los microorganismos.
Therefore, it is known that microbial fermentation for the purification of fructose is characterized by low production cost and simple process, but the composition of the product is more complex, and the quality of the product is affected by a variety of factors.
Extracción enzimática
La extracción enzimes un método que utiliza enzimas para catalizar la descomposición de los componentes de la pared celular de las células vegetales, resultando en la ruptura de la pared celular y la lixiviación de sustancias intracelulares, logrando así el propósito de la extracción. Las enzimas comúnmente utilizadas para la extracción de fructosa incluyen pectinasa y celulasa, así como enzimas complejas.
Zhong Xianfeng et al [50] obtuvo la patente de invención autorizada "un método para extraer la fructosa de alta pureza de las barras de plata" En 2019, que utilizó papaína y enzimas vegetales compuestas combinadas con la extracción de alcohol, y obtuvo la fructosa con una pureza de 95,00%-99,90% después de una serie de eliminación de impurezas y proceso de refin, lo que demuestra que el método de extracción de enzimas tiene las ventajas de bajo costo material, proceso y tecnología, y la capacidad de extraer la fructosa.
Se puede ver que el método de extracción enzimtiene las ventajas de bajo costo del material, proceso simple, condiciones de reacción suaves y alta tasa de extracción. Sin embargo, también tiene algunas limitaciones, principalmente debido a más factores que afectan la actividad enzim, como la temperatura y el valor del pH, etc. Si la actividad enzimática va a alcanzar el máximo, las condiciones óptimas de reacción están dentro de un rango muy pequeño, que necesitan ser controladas con precisión, de lo contrario la actividad enzimse reducirá en gran medida, afectando el efecto de extracción. La comparación de los diferentes métodos de extracción se muestra en la tabla 1.
• una modificación de la directiva del Consejo relativa a la armonización de las legislaciones de
3.1 separación por membranas
After crude extraction, there are many impurities in the extract, mainly proteins, Otras materias materias materias materias materias materias materias materias materias materias materias materias materias materias, salts, amino acids, etc. Membrane separation requires the selection of filter membranes with good impurity removal and recovery according to the nature of the impurities.
El principio de la separación de membranas es utilizar la permeabilidad selectiva de membranas para separar y puridiferentes sustancias. Las membranas de separación comunes utilizadas en la investigación incluyen membrana de ultrafiltración, membrana de ósmosis inversa, membrana de nanofiltración, membrana de electrodiálisis y así sucesivamente. La membrana de ultrafiltración, la membrana de nanofiltración y la membrana de osmosis inversa son todas membranas de filtración. La membrana de ultrafiltración tiene un tamaño de poros de 1 nm-300 nm, que puede utilizarse para retener algunas biomacromoléculas y sustancias coloid; La membrana de nanofiltración puede retener sustancias con pesos moleculares relativos de 300 a 1.000; La membrana de ósmosis inversa se basa en el principio de que mediante la aplicación de una cierta cantidad de presión al extremo de alta concentración de la membrana, se forma una diferencia de presión entre los dos lados de la membrana, lo que hace que las moléculas de disolvente se transfieran de la alta concentración al extremo de baja concentración de la membrana.
El principio de la membrana de ósmosis inversa es que al aplicar una cierta presión al extremo de alta concentración, se forma una diferencia de presión en ambos lados de la membrana, haciendo que las moléculas de disolvente se transfieran de la alta concentración al extremo de baja concentración. Min Zhang et al. [29] usó agua desionizada como disolvente para extraer la fructosa de radio et Rhizoma Dioscoreae y la purimediante la combinación de membranas de nanofiltración y ósmosis inversa. Las membranas de nanofiltración y ósmosis inversa utilizadas en el experimento pudieron ser reutilizadas después de la limpieza, y sus tasas de recuperación de permede membrana fueron del 95,52% y 97,22%, respectivamente.

Una membrana de electrodiálisis es esencialmente una membrana de intercambio iónico cargada [51]. La membrana se encuentra entre el cátodo y el ánodo del campo eléctrico de la solución. Cuando el campo eléctrico opera, los aniones y cationes en la solución se mueven de manera direcy pasan a través de la membrana de electrodiálisis selectiva de iones, eliminando así ciertos iones cargados.
La alta eficiencia de desalinización de las membranas de electrodiálisis ha llevado a su uso en aplicaciones industriales de desalinización como la desalinización de agua de mar [52] y el tratamiento de aguas residuales [53]. En la industria alimentaria se puede utilizar para eliminar sales inorgánicas, proteínas, etc. Duan Shuran et al. [54] utilizaron la electrodiálisis para puriel extracto de azúcar de semilla de algodón, en este estudio investigaron los efectos de los cambios en la tensión de funcionamiento y el flujo de circulación sobre el efecto de purificación y el consumo de energía. En este estudio, investigaron los efectos de los cambios en la tensión de operación y el flujo de circulación en el efecto de purificación y el consumo de energía. Los resultados finales mostraron que la tasa de desalinización podría alcanzar hasta el 91,20% y la recuperación del azúcar de algodón alcanzó el 94,50%.
Purificación por cromatode columna
La cromatode columna, también conocida como cromatoo cromato, es un método clásico para separar mezclas multicomponentes en experimentos científicos, y puede ser utilizado para operaciones cualitativas, cuantitativas y de purificación. Las columnas cromatográficas suelen consistir en una fase estacionaria y una fase móvil, y se pueden clasificar en muchas categorías de acuerdo con los diferentes rellenen en la columna, tales como cromatode carbono-calcio [55], cromatode intercambio anide de alto rendimiento (HPAC) [56], y n-fenilfenillamino - - ciclodextrina conjugquiral de fase estacionestacionaria de alto rendimiento (HPLC) [57], etc.
Todos ellos trabajan sobre el mismo principio. Sus principios de trabajo son los mismos, después de que la muestra entra en la columna, de acuerdo con los diferentes coeficientes de partición entre la fase móvil y la fase estacionaria, y la diferente capacidad de adsorde la fase estacion, los componentes se mueven hacia abajo a diferentes velocidades, y luego salen y se recogen en un cierto orden, con el fin de lograr el propósito de separación y purificación.
Cuando se utiliza la cromatode columna para la determinación de oligosacáridos, a menudo se combina con la espectrometría de masas, y la cromatolíquida de alto rendimiento (HPLC) es un método más preciso para la determinación de oligosacáridos [58], que tiene las ventajas de un tiempo analítico más corto, alta selectividad y alta sensibilidad. Wang et al. [59] desarrollaron un método para la determinación simultánea de glucósidos cíclicos de éter alílico y oligosacáridos (sacarosa, disacárido de miel, azúcar de algodón, manosa y trehalosa) en Dixiandra chinensis. En este estudio, se realizó una rápida separación de siete analitos mediante cromatolíquida de interacción hidrofílica, y los analitos fueron finalmente detectados por espectrode masas en tándem cuadrupolar triple (TQ-MS/MS) con sensibilidad y selectividad, lo que mostró que los coeficientes de correlación de los analitos estaban por encima de 0.99, con buena linealidad, y la desviación de precisión fue menor de 5.00%, y las recuperaciones estuvieron en los rangde 93.80%~105.50%.
Cuando la cromatode columna se utiliza para la purificación de fructosa, los rellende fase estacioncomúnmente utilizados son resinas, carbón activado, etc. Las resinas se dividen en resinas de intercambio iónico, resde adsormacropor, y resinas de tipo gel. Las resinas se dividen en resde intercambio iónico, resde adsormacroporosa y resde tipo gel, cuyo principio es utilizar el efecto de adsorde la resina para retener componentes específicos, y luego elupara lograr el propósito de separar los componentes de la muestra, que tiene las ventajas de alta tasa de desalinización, buen efecto de decoloración, automatización y reciclaje repetido, y así sucesivamente. Las resinas de intercambio iónico y las resinas de adsormacroporosas se utilizan comúnmente para la eliminación de sales, pigmentos, proteínas, aminoácidos y otras impurezas del extracto de fructosa.
En el estudio de Xie Jin [49], en la extracción de fructosa del gusanos de seda herbáceo seco, la tasa de elución de la proteína fue de 93.70%, la tasa de elude de ceniza fue de 97.81%, y la tasa de decoloración fue tan alta como 99.50% mediante el uso del tipo D001 de resina de intercambio de cationes macroporosa fuertemente ácida y el tipo D301 de resina de intercambio de aniones macroporosa débilmente alcalcon la tasa de flujo de 3.77 BV/h y la temperatura a 35 °C. Los resultados de este estudio fueron los siguientes: (1) la tasa de elución de proteína y ceniza fue del 97.81%, y la tasa de decoloración fue del 99.50%; Y (2) la tasa de elución de proteína y ceniza fue 99.50%. Cong Liu et al [60] usaron gel HW-40C como fase estacionpara eliminar proteínas y puriazúcar de semilla de algodón. Bajo las condiciones óptimas de proceso, la pureza del azúcar de semilla de algodón fue de 89.10%, y el rendimiento fue de 64.80%. La resina de gel tiene las ventajas de una alta eficiencia de separación y fácil operación, pero debe tenerse en cuenta que el espacio de poros de la resina de gel es pequeño, por lo que si el extracto contiene más pigmentos, deben ser eliminados primero, de lo contrario la resina de gel será fácilmente obstruida por las moléculas de pigmento, lo que resulta en el fenómeno de "enven" De la resina.
El carbón activo es un medio poroso con una alta capacidad de adsorde compuestos orgánicos hidrofóbicos y se utiliza a menudo para la decoloración. El principio es utilizar la fuerza electrostática para adsorfísicamente pequeñas moléculas orgánicas o moléculas hidrofóbicen los microporos de carbón activo para eliminar impurezas de la fase móvil. Bao et al[61] utilizaron carbón activado para adsory separar el azúcar de semilla de algodón y la sacarosa, y a través del ciclo de adsory desorción, la pureza del azúcar de semilla de algodón fue superior al 90.00%, con una tasa de recuperación del 79.20%. Bernal et al[62] utilizaron carbón activado en polvo de Norit (NPAC) a una concentración de 5 g/L, con una presión transmembrana de 100 kPa y una presión de ultrafiltración de 100 kPa. Bernal et al.[62] melaza decolorde remolacha a una concentración de 5 g/L de carbón acti- vado en polvo de norit (NPAC), una presión transmembrana de 100 kPa, un flujo de alimentación de 4,24 L/h y un pH de 3. El color de la melaza de remolacha se redujo en más del 96,50%, y el carbón activado se reconstituyó con NaOH, y la pérdida de su capacidad de eliminación de color fue inferior al 10,00%.
3.3 cristalización
El principio de la cristalización es que de acuerdo con las diferentes condiciones de cristalización de las diferentes sustancias, las sustancias extraídas se precipitan de la solución saturada y se cristaliza, mientras que otras impurezas permanecen en la solución, con el fin de lograr el propósito de purificación. En el campo de la preparación de la fructosa, Zhang Jinze et al[63] purila mediante el uso de recristalización y adsorde carbón activado. La recristalización se refiere a la cristsecundaria de cristales, es decir, el proceso de cristalización de cristales de disolución o de fusión después de la disolución o fusión, y la recristalización puede purila la sustancia a un alto grado, y la pureza de los cristales de fructosa obtenidos por este método es superior al 99,00%, que fue autorizado por una patente de la patente de invención China en 2016.
Este método fue autorizado por la patente de invención China en 2016. Song Jianmin et al[64] inventinvent" un método para la preparación de fructosa de alta pureza ", en el que los cristales de fructosa con una pureza superior al 99,00% se obtuvieron a partir de la materia prima de Fagus sylvatica por múltiples métodos de extracción, tales como la extracción acuosa, fermentación microbiana, extracción de alcohol, etc, y combinado con la precipitación alcalina, filtración, decoloración de carbón activado, y métodos de enfriamiento y cristalización de purificación. La purificación de la fructosa por el método de cristalización se caracteriza por una alta pureza, solvente respetuoso del medio ambiente y un proceso simple, y se puede utilizar para la preparación de productos estándar comerciales de fructosa, pero el período de enfriamiento natural y la cristalización es largo y la eficiencia es baja. La comparación de los tres métodos de depuración se muestra en el cuadro 2.

4 resumen y perspectivas
Compared with other oligosaccharides, fructose can more effectively promote the growth and reproduction of intestinal probiotics, and has a broad application prospect. The production and preparation of fructose is a popular research direction at present, and this paper summarizes the current status of the technology of fructose preparation in terms of the extraction process and purification process. In terms of economic benefits, microbial fermentation is currently the most economical method for the purification of fructose, and it is more suitable for industrial production, in which the mixed-bacteria fermentation is better than the single-bacteria fermentation, and the simultaneous multibacteria fermentation is better than the lagging fermentation, the pH value of the fermentation environment depends on the fermentation bacteria, and the pH value of 5.5-7.0 is usually suitable, the shaking fermentation is better than the static fermentation, and the slag fermentation is better than the filtration fermentation. In addition, the purification rate can be adjusted by adding some enzyme inhibitors to realize low-cost and high-efficiency mass production of fructose.
Sin embargo, el método de fermentación microbiana tiene la desventaja de muchas impurezas en el producto, que deben ser eliminadas en múltiples pasos en el proceso de refinposterior. Aunque la pureza de algunos procesos en la purificación de la fructosa ha alcanzado las normas internacionales y se puede utilizar para producir normas de prueba de alta pureza, hay algunas limitaciones.
Por ejemplo, el método de separación por membrana y el método de purificación por cromatoen columna presentan los problemas del elevado coste de los consumibles y de la escasa capacidad de procesamiento; El costo de tiempo del método de cristes directamente proporcional a la capacidad de producción e inversamente proporcional a la zona de evapor, que no son adecuados para la purificación a gran escala de la fructosa. Por lo tanto, el establecimiento de un método eficiente y de bajo costo para la purificación de la fructosa, que se pueda aplicar a la producción industrializada en masa, es una dirección que necesita ser investigada en el campo del procesamiento y aplicación de la fructosa en el futuro.
Referencias:
[1] TOSCANO M, DE GRANDI R, PASTORELLI L, et al. Un consumidor y#39;s Guide for probiotics: 10 Golden rules for a right use[J]. Enfermedad digestiva y hepática, 2017, 49(11): 1177-1184.
[2] rama de microecología de la asociación de medicina preventiva China. Consenso sobre la aplicación clínica de los reguladores microecológicos del tracto digestivo en China (edición 2016)[J]. Chinese Journal of Microeco-logy, 2016, 28(6): 621-631.
[3] sociedad probiótica del Instituto chino de ciencia y tecnología de los alimentos. Consenso científico sobre probióticos (2020)[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20 (5): 303-307.
[4] SCOTT K P, GRIMALDI R, CUNNINGHAM M, et al. Developments in understanding and Application prebiotics in Research and practice- an ISAPP Conference paper [J] (en inglés). Journal of Applied Microbiology, 2020, 128(4): 934-949.
[5] HUNGIN A P S, MITCHELL C R, WHORWELL P, et al. Revisión sistemática: los probióticos en el manejo de los síntomas gastrointestinales inferiores — una revisión sistemática actualizada de las pruebas: los probióticos en el manejo de los síntomas gastrointestinales inferiores — un consenso internacional basado en la evidencia actualizado [J]. Farmacología alimentaria & Therapeutics, 2018, 47(8): 1054-1070.
[6] BAJURY D M, NASHRI S M, KING JIE HUNG P, et al. Evaluation of potential prebiotics: a review[J] (en inglés). Food Reviews International, 2018, 34(7): 639-664.
[7] GIBSON G R, ROBERFROID M B. moddietde la microbiota colónica humana: introducción del concepto de prebióticos [J]. The Journal of Nutrition, 1995, 125(6): 1401-1412.
[8] LI C N, WANG X, LEI L, et al. La berberina combinada con estachyose induce mejor glicometabosm que la berberina sola a través de la modulación de la microbiota intestinal y la metabolómica fecal en ratones diabéticos [J]. Phytotherapy Research, 2020, 34(5): 1166-1174.
[9] zártl B, SILBERBAUER K, LOEPPERT R, et al. Fermentación de oligosacáridos y galactomannanos no digeribles de la familia de las rafinosas por probióticos [J]... Comida y comida Función, 2018, 9(3): 1638-1646.
[10] LIU Y Y, LI T, ALIM A, et al. Efectos reguladores de la stachyose sobre la inflamación colónica y hepática, disbiosis de la microbiota intestinal, y alteración de la distribución de células T CD4(+) en ratones alimentados con dieta alta en grasa [J]. Journal of Agricultural and Food Chemistry, 2019, 67(42).
11665-11674.
[11] ZHONG X F, ZHANG Y B, HUANG G D, et al. Análisis proteómico de la contribución de la estaquiosa al crecimiento de Lactobacillus acidophilus CICC22162[J]. Comida y comida Function, 2018, 9(5): 2979-2988.
[12] BHATIA L, SHARMA A, BACHHETI R K, et al. Lignocelulde oligosacáridos funcionales: producción, propiedades y beneficios para la salud [J]. Bioquímica preparativa & Biotechnology, 2019, 49(8): 744-758.
[13] LIANG Lixin. Oligosacarido-estaquiosa funcional [J]. China Food Additives, 2004(4): 51-54.
[14] francés D. La familia raffinosa de oligosacáridos [J]. Avances en química de carbohidratos, 1954, 9: 149-184.
[15] VAN DEN ENDE W. Multifunctional fructans and raffinose Family oligodes [J]. Frontiers in Plant Science, 2013, 4: 247.
[16] HAN Shiwen, GAO Jiatao, SANG Ruojie, et al. La función y el mecanismo de la estaquiosa en el tracto intestinal [J]. Food Science and Te- chnology, 2019, 44(4): 281-284.
[17] MA Xuan. Estudio sobre el proceso de extracción y purificación de estaquiosa en Stachys sieboldii Miq[D]. Shenyang: Shenyang University of Che- Mical Technology, 2019 (en inglés).
[18] LI T, LU X S, YANG X B. evaluación de la seguridad clínica y los efectos beneficiosos de los oligosacáridos de estaquiosa -enriquecidos con -galacto -oligosacáridos sobre la microbiota intestinal y la función intestinal en humanos [J]. Comida y comida Function, 2017, 8(1): 262-269.
[19] CHEN X F, LIAO D Q, QIN Z X, et al. Interacciones sinérgicas de catalpol y stachyose en ratones diabéticos inducidos por STZ-HFD: syner- gism in regulation of Blood glucose, lipi, and liver and renal function[J]. Chinese Herbal Medicines, 2019, 11(1): 70-77.
[20] HE L W, ZHANG F, JIAN Z Y, et al. La estachyose modula la micro biota intestinal y alivia la colitis aguda indupor sodio sulfato de dextranen en ratones [J]. Saudi Journal of Gastroenterology: Official Journal of the Saudi Gastroenterology Association,2020,26(3):153-159.
[21] KENNEDY P J, MURPHY A B, CRYAN J F, et al. Microbioma en función cerebral y salud mental [J]. Tendencias en ciencia alimentaria & Te- chnology, 2016, 57: 289-301.
[22] GIACOBBO A, BERNARDES A M, DE PINHO M N. operaciones DE membrana condupor presión secuencial para recuperar y fraccionar polifenoles y polisacáridos DE lías DE vino DE segunda racde [J]. Tecnología de separación y purificación, 2017, 173: 49-54.
[23] LI Bingxue, NIU Fei, ZHANG Ning. Síntesis enzimde oligosacáridos funcionales [J]. Journal of Microbiology, 2017, 37(1): 1-6.
[24] NAKATA H, SAKURAI H, NAGURA T, et al. Producción de rafinosa usando galactosidasa de Paraphaeosphaeria sp[J]. Mycoscience, 2013, 54(4): 247-251.
[25] WANG Donghui, LIAO Na, SUN Peng, et al. Cambios en el contenido de azúcar en transporte en diferentes órganos de Rehmannia glutinosa[J]. China Journal of Chinese Materia Medica, 2018, 43(8): 1563-1570.
[26] ZHENG Yunfeng, CHENG Jianming, DING Ning, et al. Método para la preparación de la estaquiosa mediante el uso de agua de extracción de alcohol y precipitación de Salvia miltiorrhiza: CN102229627A[P]. 2011-11-02.
[27] CHEN Yan, ZHONG Xianfeng, HUANG Guidong, et al. Condiciones de extracción de Stachys floridana shuttlw. Ex Benth.[J]. Investigación y desarrollo de productos naturales, 2011, 23(1): 123-130.
[28] GERLIANI N, HAMMAMI R, AIDER M. extracción de proteínas y carbohidratos de la harina de soja utilizando soluciones ácidas y alcalinas producidas por electroactivación [J]. Ciencia de los alimentos & Nutrición,2020,8
(2):1125-1138.
[29] ZHANG Min, SHI Baoli. Aplicación de la tecnología de separación por membrana en la extracción de estaquiosa [J]. The Food Industry, 2019, 40(10): 102-106.
[30] YIN J F, YANG G L, WANG S M, et al. Purificación y determinación de la alcachofa China stachyosein (Stachyssieboldii Miq.) por cromatolíquida de alto rendimiento con detección de dispersión de luz evapor[J]. Talanta, 2006, 70(1): 208-212.
[31] YAO Hong. Stduy on the preparation Technology of stachyose from Stachys sieboldii Miq[D] (en inglés). Wuxi: universidad Jiangnan, 2010.
[32] ZHONG X F, HUANG G D, CHEN Y, et al. Optimización del extracto de estaquiosa de Stachys floridana shuttlw. Ex Benth. Por metodología de superficie de respuesta [J]. Journal of Food Science and Technology, 2013, 50(5): 942-949.
[33] CHEMAT F, ROMBAUT N, SICAIRE A G, et al. Extracción por ultrasonidos de alimentos y productos naturales. Los mecanismos, técnicas, combinaciones, protocolos y aplicaciones. Protocolos y aplicaciones. Una revisión [J]. Ultra- Sonics Sonochemistry, 2017, 34: 540-560.
[34] XI J, SHEN D J, LI Y, et al. Extracción a ultraalta presión como herramienta para mejorar las actividades antioxidantes de los extractos de té verde [J]. Food Re - search International, 2011, 44(9): 2783-2787.
[35] MITTAL R, TAVANANDI H A, MANTRI VA, et al. Métodos ecosistémicos para mejorar la extracción de ficobiliproteínas de macroalgas marinas. Gelidiumpusillum (Rhodophyta)[J]. Ultrason- ICS Sonochemistry, 2017, 38: 92-103.
[36] BHANGU SK, GUPTAS, ASHOKKUMARM. Mejora ultrasónica de la transestericatpor lipase para la síntesis de biodiesel [J]. Ul - trasonics Sonochemistry, 2017, 34: 305-309.
[37] WANG Qiwei, REN Jianlin. Extracción ultrasónica de Stachys sieboldii Miq[J]. Aplicación de industria petroquímica, 2014, 33(6): 97-99.
[38] HU Binjie, CHEN Jinfeng, WANG Gongnan. Estudio comparativo sobre extracción de polisacáridos de Ganoderma lucidum por método ultrasónico y estudio comparativo tradicional sobre extracción de polisacáridos de Ganoderma lucidum por método ultrasónico y método tradicional de agua caliente [J]. Ciencia y tecnología de la industria alimentaria, 2007, 28(2): 190-192.
[39] CHEN CHUANYUN, LIANG YUANZHENG, LI SHENGMING. Proceso de extracción de membrana para stachyose in Stachys sieboldii: CN106543238A[P]. 2017-03-29.
[40] WU S J, CHEN Y W, WANG C Y, et al. Antiinflamatorios propios de extractos asistidos a alta presión de Grifolafrondosa en lipo- lisacárido - macrófagos cru264.7 activactiv[J]. Ciencia de los alimentos & Technology,2017,52(3):671-678.
[41] HONG Feng, SHAN Gu, SUN Weidong, et al. Un estudio primario sobre la producción de xilo-oligosacárido con explosión de vapor [J]. Journal of Chemical Industry of Forest Products, 1999, 33(6): 3-6.
[42] ZHANG Bailiang. Bioenergy Technology and Engineering [M] (en inglés). Beijing: Science Press, 2009: 84-103.
[43] LIN T J, LEE Y C. producción de fructooligosacáridos de alto contenido utilizando dos microorganismos inmovilizen un biorreactor de transporte aéreo de bucle interno [J].. Journal of the Chinese Institute of Chemical Engineers, 2008, 39(3): 211-217.
[44] WANG Zhirong. Estudio sobre la producción de estaquiosa de alta pureza de Stachys sieboldii Miq[D]. Guangzhou: universidad de tecnología del sur de China, 2017.
[45] SHU Danyang, XIE Jin, CUI Chun. Estudio sobre la preparación de estaquiosas de alta pureza por fermentación microbiana [J]. China Condiment, 2019, 44(5): 1-4.
[46] SHI C Y, ZHANG Y, LU Z Q, et al. Fermentación en estado sólido de harina de maíz y soja mezclada con Bacillus subtilis y enterococus faecium para degradar los factores antinutricionales y aumentar el valor nutritivo [J]. Journal of Animal Science and Biotechnology, 2017, 8: 50.
[47] WANG Xue, ZHANG Jinze, DUAN Sufang, et al. Estudio sobre la purificación de la estaquiosa por fermentación [J]. Food and fermentación Indus - tries, 2010, 36(10): 94-97.
[48] ZHOU Wensi, XIONG Jian, XIE Jin, et al. Estudio sobre la extracción y purificación de la estaquiosa de Stachys seiboibi por método de fermentación [J]. China Condiment, 2018, 43(7): 21-25, 32.
[49] XIE Jin. Estudio sobre la mejora de la pureza de las estaquiosas utilizando un método de fermentación microorgánica [D]. Guangzhou: universidad tecnológica del sur de China, 2018.
[50] ZHONG XIANFENG, HUANG GUIDONG, BAI YONGLIANG, et al. Método para extraer estaquiosa de alta pureza de Stachys flori- Dana shuttlw. Ex Benth. CN106496287A[P]. 2017-03-15.
[51] ATUNGULU G, KOIDE S, SASAKI S, et al. Electrodiálisis mediada por membrana de intercambio iónico de caldo de vieira: Ion, aminoácidos libres y perfiles de metales pesados [J]. Journal of Food Engineering, 2007, 78(4): 1285-1290.
[52] GALAMA A H, SAAKES M, brüning H, et al. Predesalinización del agua de mar con electrodiálisis [J]. Desalinización, 2014, 342: 61-69.
[53] LV Y, YAN H Y, YANG B J, et al. Electrodiálisis con membrana Bipolar para el reciclado de aguas residuales de clorde amonio: estudio de la membrana y optimización del proceso [J]. Chemical Engineering Research and Design, 2018, 138: 105-115.
[54] DUAN Shuran, BAO Zongbi, WEN Guangdong, et al. Desalinización electrodialítica en la purificación de raffinose [J]. Food Science, 2016, 37(1): 28-32.
[55] YAMAMORI A, TAKATA Y, FUKUSHI E, et al. Análisis estructural de un nuevo oligosacárido aislado de bebida fermentde extractos de plantas [J]. Journal of Applied Glycoscience, 2017, 64(4): 123-127.
[56] MENGY, YIL, CHEN L, et al. Purificación, caracterización estructural y actividad antioxidante de polisacáridos de Saposhnikovia di - varicata [J]. Chinese Journal of Natural Medicines, 2019, 17(10): 792- 800.
[57] LI L, CHENG B P, ZHOU R D, et al. Preparación y evaluación de una nueva fase estacionestacionquirunida a N -bencil-fenetilamino - - ciclodextrina para HPLC[J]. Talanta, 2017, 174: 179-191.
[58] ZHOU Yang, LIU Li, GUO Lengqiu, et al. Determinación del contenido de stachyose in Radix-rehmanniae pieces by HPLC-ELSD[J]. Medicina tradicional de Asia — Pacífico, 2019, 15(5): 53-56.
[59] WANG X, WU C T, XU M, et al. Optimización para la desterminación simultánea de glucósidos iridoides y oligosacáridos en Radix Rehmannia por extracción asistida por microondas y HILIC-UHPLC - TQ-MS/MS[J]. Análisis fitoquímico, 2020, 31(3): 340-348.
[60] LIU Cong, BAO Zongbi, XING Huabin, et al. Separación y purificación de la rafinosa y proteínas por cromatode permeación en gel [J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28 (3): 503-509.
[61] BAO Z B, DUAN S R, ZHANG Z G, et al. Adsoradsorseparación de la rafinosa de la sacarosa por carbón activo: equilibrio, cinética y ruptura dinámica [J]. Ciencia y tecnología de separación, 2016, 51(10): 1636-1644.
[62] BERNAL M, RUIZ M O, GEANTA R M, et al. Eliminación del color de la melaza de remolacha mediante ultrafiltración con carbón activado [J]. Chemical Engineering Journal, 2016, 283: 313-322.
[63] ZHANG Jinze, LIN Jing, ZHOU Zhijiao, et al. Método para preparar el cristal de estaquiosa: CN103265583A[P]. 2013-08-28.
[64] SONG Jianmin, WANG Dehai, WAN Rongsheng, et al. Método de preparación de la estaquiosa de alta pureza: CN110759956A[P]. 2020-02-07.
-
anterior
Green Spring Technology Provides One-Stop Solutions for Vanillin Powder
-
siguiente
¿Se puede utilizar la estaquiosa en la alimentación Animal?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés



