¿Se puede utilizar la estaquiosa en la alimentación Animal?
Fabricación en la cual:belongs to α-galactose oligomers and is mainly found in various plants such as the Lamiaceae, Fabaceae, and Scrophulariaceae families, especially in plants in the Lamiaceae family's Osmundaceae género. Actualmente, los principales métodos para la preparación de la estaquiosa son la extracción física y los métodos enzim. Usando plátano, hierba vernal dulce y stachys tuberifera como materias primas, el contenido de estaquiosa extraído usando el método de extracción física es generalmente de 20% a 70% [1]. Usando stachys tuberifera como materia prima, la pureza de la estaquiosa preparada usando purificación biológica y técnicas industriales de separación cromatoes tan alta como 90% [2].
El contenido de estaquiosa en los oligosacáridos de soja producidos a partir de soja y sus subproductos procesados es generalmente de 18% a 71%. En la definición de oligosacáridos de soja en GB/T 22491-2008, los oligosacáridos de soja con una pureza del 75% generalmente contienen 18% estaquiosa, 6% rafinosa y 24% sacarosa. Zhang Shuangshuang et al. [3] extrajo estaquiosa con una pureza de 90% al fermentar suero de proteína de soja con levadura. La estaquiosa es también el principal componente funcional de los oligosacáridos de soja [4]. En los últimos años, la investigación sobre la estaquiosa en China ha aumentado gradualmente. Además de los campos originales de la alimentación y la medicina, la aplicación de la estaquiosa en la producción animal también ha atraído cada vez más atención.
1 estructura Molecular y propiedades físicas y químicas de la estaquiosa
La estaquosa se compone de una molécula de − -glucosa, una molécula de − -fructosa y dos moléculas de − -galactosa, Unidas de la manera de galactosa (− 1 − 6) -galactosa (− 1 − 6) -glucosa (− 1 − 2 −) -fructosa, y por lo tanto también se conoce como una tetrosa [5]. La fórmula molecular de la estaquiosa es C24 H42 O21, con una masa molecular relativa de 666,59. La fórmula de la estructura molecular se muestra en la figura 1. De acuerdo con la difracción de un solo cristal de rayos x, la estachyosa pertenece al sistema cristalmonoclínico y forma una estructura de capas tridimensional a través del enlace de hidrógeno [5-6], como se muestra en la figura 2.
Figura 1 fórmula de la estructura Molecular de la estaquiosa
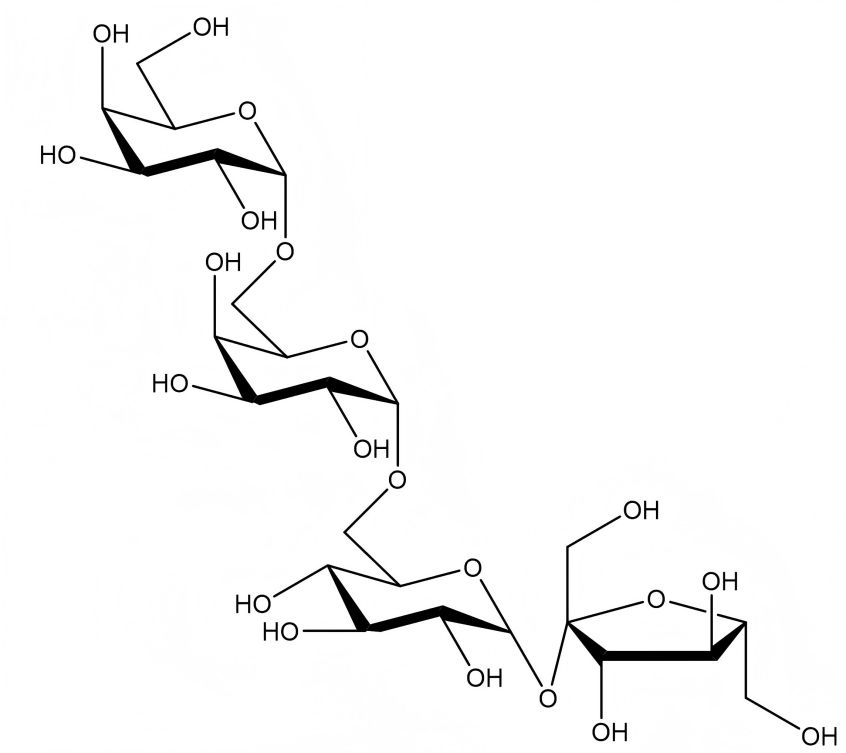
Pure stachyose is a white Polvo polvo polvo. Its sweetness is 22% that of sucrose, and it has a refreshing taste with no peculiar smell. Stachyose crystallizes into small crystals combined with 4 molecules of water. It is easily soluble in water, with a solubility of 130 g (20 °C). It is insoluble in organic solvents such as ether and ethanol. Its melting point is 101 °C. It can lose its crystal water when heated in a vacuum. The melting point of anhydrous stachyose is 167 ~ 170 ℃, and its moisture retention and moisture absorption are both lower than those of sucrose. It has no reducing properties. Guo Meili et al. [7] proved in a series of toxicological tests that stachyose is safe and non-toxic.
2 aplicación de estachyose en la industria alimenticia
Debido a la falta de enzimas digestivas que digienlaces -1,6-glicosídicos en el sistema digestivo de los seres humanos y animales monogástri, la estaquosa puede entrar directamente en el extremo posterior del tracto digestivo, donde es fermentada y utilizada por bifidobacterias y un pequeño número de lactobacilos en el intestino. Por lo tanto, los oligosacárino digeribles como la estachyosa también se conocen como fibra dieto prebióticos [8]. El desarrollo y la utilización de los fructooligosacáridos se ha generalizado en los países desarrollados como los Estados Unidos, Japón y Europa. Con la madurez de la tecnología de producción de fructooligosacáridos y la promoción de su aplicación, sus perspectivas de desarrollo han atraído gradualmente la atención y la atención de China. Hoy en día, hay 153 patentes relacionadas con los fructooligosacáridos en China, incluyendo 29 patentes sobre la tecnología de producción de fructooligosacáridos, 2 patentes sobre la tecnología de pruebas de fructooligosacáridos, y el resto son todas las patentes sobre la aplicación de fructooligosacáridos [1].
2.1 regular el equilibrio de la flora intestinal
Hayakawa et al. [9] mostraron que los oligosacáridos de soja que contienen 23% y 71% de rafinosa después de la purificación pueden ser utilizados eficazmente por Bifidobacterium en el intestino humano, aumentando significativamente el número de bifidobacterias en las heces. Luo et al. [10] prepararon un medio de cultivo con oligosacáridos de soja, estaquiosa, rafinosa y sacarosa como base e lo inocularon con Bifidobacterium adolescentis y Escherichia coli a partir de heces humanas, respectivamente. Encontraron que la estaquiosa era el principal factor que promovía el crecimiento de las bifidobacterias. Shu Guowei et al. [11] mostraron que la adición de 0,8% y 1,0% de raffinose al medio para las bacterias de ácido lác(MRS) puede acelerar significativamente el crecimiento de Bifidobacterium bifidum BB01. Además de utilizar preferentemente oligosacáridos no digeribles en el intestino, Bifidobacterium también puede consumir preferentemente xilosa en condiciones donde coexisten múltiples oligosacáridos no digeribles. Por lo tanto, la xilosa puede directa y selectivamente proliferar Bifidobacterium [12].
2.2 mejora el body's función inmune
Debido ala estructura de -1,6-galactosa en la molécula de la rafinosa, y basado en el mecanismo molecular del receptor simpatico-activado, está involucrado en procesos biológicos tales como la adsorción entre células inmuny patógenos. Esto le da a la raffinose la función de prevenir la infección por patógenos, neutralizar toxinas y regular el sistema inmune [13]. Después de que a los ratones se les administró una dosis diaria de 0,2 mL de sacarosa soluble en agua (por 10 g de peso corporal) por gavage durante 30 días consecutivos, se encontró que su inmunidad corporal y la función de los macrófagos mononucleares eran positivas [14]. Además, bajo la acción de las bifidobacterias, la sacarosa soluble en agua se puede descomponer para producir múltiples factores de la función inmune que mejoran el body's inmunidad.
2.3 alivia el estreñimiento y previene la diarrea
Xylooligosacáridos son pequeños,Fibras dietéticas solubles en aguaQue son utilizados preferentemente por bifidobacterias en el intestino grueso, produciendo grandes cantidades de ácidos grasos de cadena corta como ácido acético, ácido propiónico y ácido butírico [15]. Se ha reportado que 103 pacientes estreñidos que tomaron un suplemento diario que contenía 5 g de xilooligosacáridos experimentaron movimientos intestmejory función intestinal mejorada [16]. Además, la molécula de fructan tiene un gran número de grupos hidroxilo, que pueden absorber bien el agua en el intestino, aliviando la diarrea [17]. Además, el fructan también tiene las funciones de protección del hígado, la inhibición del cáncer, la inhibide la dermatitis atópica, anti-artritis, la prevención de la caries dental, la prevención de la colitis, la excreción de plomo, la disminución de la presión arterial y los lípidos en la sangre, anti-oxidy anti-envejecimiento [18].
3 aplicación de estachyose en la alimentación animal
3.1 efecto de la estaquiosa en la flora intestinal de aves de corral
Pacifici et al. [19]mostraron que la inyección artificial de 5% y 10% de raffinosa en la cavidad amniótica de embriones de pollo incubhasta el día 17 e incubhasta el día 21 (eclo) mostró que la raffinosa o raffinosa tenía un efecto beneficioso sobre la flora intestinal, la utilización biológica del hierro y la función morfológica del tejido de la mucosa intestinal en embriones de pollo. Xilooligosacáridos pueden ser fermentados y utilizados por Bifidobacterium y un pequeño número de Lactobacillus en el ciego de pollos de engor, y su tasa de fermentación es sólo en segundo lugar a la de la rafinosa en oligosacáridos de soja [20].
Yi Zhonghua [21] mostró que la adición de 1,0% de una preparación de xilooligosacáridos a la alimentación aumentó significativamente el número de bifidobacterias y lactobacilos en la digesta cecde pollos de engor, y redujo significativamente el número de Escherichia coli y Salmonella en la digesta cecal. Lan et al. [22]usaron bacterias del ciego de pollo de engorde de 14 días de edad como inóculo y oligosacáridos de soja fermentados in vitro. Los resultados mostraron que, en comparación con los oligosacáridos de soja y la rafinosa, la estaquiosa tuvo la mayor producción de gas y la mayor tasa de producción de gas, e inhibió significativamente el crecimiento de Escherichia coli y Clostridium perfringens. Yang Guiqin et al. [23] mostraron que la adición de 1,0% de estaquiosa aumentó significativamente la riqueza de la flora en el contenido cecin vitro de pollos de engory promovió la proliferación de bacterias en el género Brachysporangium, el género Bacteroides y el género Lactobacillus.
Bajo la acción de la fermentación de bifidobacterias, la rafinosa produce una gran cantidad de ácidos grasos de cadena corta en el intestino, lo que reduce significativamente el pH en el intestino. En este ambiente, la proliferación de bacterias dañinas puede ser inhibida y el equilibrio microecológico intestinal puede ser ajustado. Sin embargo, Jiang et al. [24]informaron que, excepto por el efecto significativo de la raffinose sobre la concentración de butirato en el ciego de pollos de engoren en la etapa inicial, no tuvo un efecto positivo en otros aspectos. Sin embargo, Yizhonghua [22] encontró en su estudio que la adición de una preparación de azúcar de agua a la alimentación aumentó significativamente la concentración de ácido acético y ácidos grasos de cadena corta en la digesta cecal de pollos de engor, así como el mol porcentaje de ácido butírico en la cantidad total de ácidos grasos de cadena corta. Aumento, el pH de los digesta cecal e ileal mostró una tendencia a la baja; Además, la adición de 0,5% de una preparación de xilosa fue capaz de reducir eficazmente el contenido de nitrógeno básico volátil en el intestino, inhibide este modo la proliferación de las bacterias putrefacintestde los pollos de engor.
3.2 efectos de la rafinosa sobre la morfode los órganos digestivos y la mucosa intestinal de las aves de corral
Factores como las poliaminas intestinales, el factor de crecimiento epidérmico, los ácidos grasos de cadena corta y el pH afectan a la estructura morfológica del tracto digestivo de las aves de corral. La mayoría de estos factores están regulados por los nutrientes presentes en el pienso, y los oligosacárino digeribles son uno de los importantes reguladores [25]. Yi Zhonghua et al. [26] mostraron que la adición de diferentes concentraciones de estachyose aumentó el peso absoluto de los órganos digestivos de los pollos de engor, especialmente el ciego y el colon. elAdición de 0,5% de estaquiosaAumentó significativamente la altura de la vellosidad del duoden, yeyuno e íleon de los pollos de engor, redujo significativamente la profundidad de la cripta del yeyuno e íleon, y aumentó la altura de la vellosidad/profundidad de la cripta del yeyuno e íleon.

3.3 efectos de la gallinosa sobre el rendimiento y la digestibilidad de las aves de corral
La rafinosa es un oligosacárido no digerible. Debido a su funcionalidad única y no digestibilidad, tiene un efecto importante en la fisiología digestiva y el metabolismo de nutrientes de los animales, lo que afecta a la digestión y absorción de diversos nutrientes y, en última instancia, el rendimiento de los animales. Jiang et al. [24] mostraron que la adición de 1,2% de raffinose al pienso en el pienso en comparación con el pienso de harina de soja normal, no hubo diferencia significativa en la digestibilidad de los nutrientes en el pienso por los pollos de engor, pero a medida que la cantidad de azúcar soluble en agua añadido aumentó, la digestibilidad de los nutrientes en el pienso por los pollos de engordisminuyó ligeramente. Yi Zhonghua [21] mostró que la adición de 0,5% de una preparación de xilooligosacárido tenía diversos grados de mejora en la tasa de utilización aparente de nutrientes en el alimento, mientras que la adición de 2,0% de una preparación de xilooligosacárido disminuyó significativamente la utilización aparente se redujo significativamente. Entre ellos, el calcio, fósforo, fibra de detergente neutro y fibra de detergente ácido fueron los más afectados por la cantidad de xilosa agregada al alimento. La razón principal es que una dosis alta de xilosa acelera el flujo del alimento en el tracto digestivo.
La adición de estaquiosa a las dietas de los pollos de engorpuede llevar a una disminución en el aumento de peso diario promedio y en la eficiencia del alimento. A medida que aumenta la cantidad de estaquiosa añadi, el crecimiento de los pollos de engormuestra una disminución lineal y una tendencia de crecimiento cuadrática [24]. Yi Zhonghua et al. [27] mostraron que existe una relación dosis-respuesta entre el efecto de la estachyosa en el rendimiento de crecimiento de pollos de engor. Una dosis baja (0,5%) mostró un ligero efecto promotor, mientras que una dosis alta (2,0%) mostró un efecto inhibit. Además, el grado de respuesta a la dosis en el período de crecimiento inicial fue mayor que en el período de crecimiento posterior.
3.4 el efecto de centrarse en la función inmune de las aves de corral
Wang Liwan et al. [2,8] mostraron que algunosoligosaccharides, including fucose, can promote the development of immune organs such as the thymus and bursa of Fabricius in egg-laying chicks, and reduce the emission of ammonia (NH3), hydrogen sulfide (H2 S) and other malodorous substances in feces. Adding 0.5% of a fructooligosaccharide preparation to the feed has a tendency to increase the spleen index of 18-day-old broiler chickens, and can significantly increase the serum immunoglobulin A (IgA) content of 18-day-old broiler chickens, but significantly reduce the spleen index of 36-day-old broiler chickens [29]. Therefore, fucose can be used as an immune enhancer to improve the immune function of animals, and its immunomodulatory effect may be achieved mainly by regulating the intestinal microecology of animals [30].
4 aplicación de focuse en la alimentación de cerdos
4.1 efecto de focuse en la flora intestinal de los cerdos
El mecanismo de acción de los xilooligosacáridos en el intestino de cerdo es el mismo que en los pollos de engor, y el efecto es también similar. Krause et al. [31]informaron por primera vez que bajo condiciones in vitro,xilooligosacáridosPuede ser completamente fermentado por la lechlechpost-destete#39;s proceso de fermentación puede acelerarse mediante la adición de altos niveles de lactosa a la dieta. Acelerar. Zhang et al. [32]mostraron que la adición de 1,0% de raffinosa a la dieta aumentó significativamente el número de Lactobacillus en el íleon porcino y el número de Bifidobacterium en el ciego y el colon, redujo significativamente el número de bacterias en el colon y aumentó significativamente el contenido de ácidos grasos volátiles en el íleon, el ciego y el colon. Sin embargo, altas dosis de raffinose pueden reducir el número de lactobacilos y bifidobacterias en el yeyuno, íleo, ciego y colon [33].
4.2 efectos de la estachyose sobre el rendimiento y la digestibilidad de los nutrientes de los cerdos
Raffinose and stachyose in soybean meal are considered to be anti-nutritional factors in monogastric animals, mainly because they ferment in the hindgut of animals and have no positive effect on the provision of metabolic energy [34]. Smiricky et al. [35]also showed that raffinose and stachyose reduced the digestibility of nitrogen and amino acids in pig feed, and that the digestibility of dry matter decreased significantly with increasing addition. It was found that adding α-galactosidase to a diet containing raffinose can eliminate this negative effect [36], because the enzyme can hydrolyze 80% of the raffinose in the small intestine of piglets, thereby significantly increasing the digestibility of dietary α-galactose. Although xylose has a negative effect on nutrient digestibility in pigs, the addition of 1.0% xylose to a soybean-free diet had no significant effect on piglet performance compared to a normal soybean meal diet, but significantly reduced the diarrhea rate of weaned piglets. However, when the addition reached 2.0%, piglet performance was significantly reduced in the first 2 weeks after weaning [32]. This shows that the dose effect of the impact of raffinose on piglet performance is very obvious, and also shows that the anti-nutritional properties of raffinose are mainly manifested in the digestibility of nutrients.

5 aplicación de estaquiosa En la producción de otros animales, como los animales acuáticos
Cai Yinghua [37] mostró que la tasa de ingesta de alimento de lengubajo aumentó significativamente con el aumento del contenido de estachyose en el alimento, pero la digestibilidad aparente de la materia seca y proteína en el alimento tendió a disminuir. Después de la adición de stachyose, raffinose, o una combinación de los dos a la alimentación, el peso y la tasa de crecimiento del salmón del Atlántico estaban entre los de una dieta que contiene harina de pescado entera y una dieta que contiene harina de soja que sustituye parte de la harina de pescado. No tuvo un efecto significativo sobre la digestibilidad de proteínas y grasas [38]. En comparación con una dieta que contenía 100% de harina de pescado, la adición de 300 g/kg de harina de soja redujo significativamente el rendimiento de crecimiento de carpas juveniles heteromorfas de plata, pero la adición de una cantidad moderada de estachyose, raffinose o estachyose + raffinose no cambió significativamente el estado de crecimiento y la morfointestinal de los peces durante el período de prueba de 8 semanas [39].
La estaquiosa tampoco tuvo un efecto significativo sobre la composición corporal y la flora intestinal de la carpa crucia híbride plata [40]. Además, la rafinosa puede mejorar la función inmune no específica de la carpa hetertróde plata crucian hasta cierto punto [41]. Se han desarrollado piensos funcionales (productos patentados) que contienen estaquiosa para la prevención y el tratamiento de la enfermedad de la piel roja en carpas de hierba [42]. Hu et al. [43]mostraron que la adición de 1,25% de rafinosa al alimento mejoró significativamente el rendimiento de crecimiento, la utilización del alimento y la actividad enzimdigestiva de los rodrodjuveniles. La adición de 1.25% y 5.00% de estaquiosa aumentó significativamente la abundancia de bacterias celulolíintestrelacionadas con la digestión y mejoró la función de barrera de la mucosa intestinal del rodrodjuvenil. Sin embargo, la adición de 2,5% a 5,0% de fructooligosacáridos también dio lugar a un aumento en el consumo de alimento y una disminución en la eficiencia del alimento del rodvo. Cuando la adición alcanzó el 5,0%, aunque el número de bacterias beneficiosas en el intestino del rodrodse incrementó, también aumentó el número de algunas bacterias potencialmente patógenas [44]. Esto demuestra que el efecto de los fructooligosacáridos sobre diferentes funciones (crecimiento, digestión, barrera mucosa intestinal, etc.) del mismo animal varía con la dosis.

Además de pollos, cerdos y peces, los efectos positivos de los fructooligosacáridos también se han demostrado en animales como gusanos de seda, monos rhesus y ratones. Chen Chuanjie et al. [45] mostraron que la adición de 0,50% de fructooligosacáridos a la dieta del gusano de seda aumentó significativamente la tasa de vida general de las pupas del gusano de seda, la cantidad de capullos completos, la cantidad de capas de capullo y la tasa de capa de capullo. Li Haifang [46] demostró que después de agregar raffinosa a la dieta del mono rhesus, el número de lactobacilos en el intestino aumentó y el número de Escherichia coli disminuyó. Después de alimentar a la estaquiosa Polvo polvo polvo Durante 6 semanas, los monos tuvieron evacuaciones intestinales normales y las heces fueron de color amarillo en apariencia y en forma de tiras suel, lo que indica que la rafinosa mejoró la función intestinal de los monos.
Además, se añade la estaquiosa powder También mejoró significativamente la inmunidad y la resistencia a la enfermedad de los macacos. Li et al. [47]encontraron en su estudio que una preparación de oligosacárido de soja que contenía 55,3% de estaquinosa, 25,8% de estaquinosa y 9,7% de estaquinosa promovió la proliferación de bacterias beneficiosas en los intestinos de ratones, inhibió la proliferación de bacterias patógenas y promovió significativamente la peristalsis intestinal y la excreción. Wei Yan et al. [48] mostraron que el simbiótico de fructooligosacarido-lactobacillus plantarum prebiótico puede mejorar significativamente la inmunidad celular específica, la inmunidad humoral y la función inmuninespecífica de ratones con inmunidad baja, aumentar las concentraciones de algunos factores inmunen el suero y mejorar la función inmunde los ratones. Un ensayo de 4 semanas de alimentación de ratas con diabetes tipo 2 (modelo) con estaquiosa encontró que la estaquiosa afecta el equilibrio de la flora intestinal al cambiar la expresión del ARNm de la flora intestinal [49]. Un estudio realizado por Jiang-li Dou et al. [50] mostró que la adición de 50 y 100 μg/mL de estaquiosa aumentó significativamente la actividad de los neutrófilos cultivados in vitro de conejos y también aumentó significativamente la capacidad de los neutrófilos para fagocitar Staphylococcus aureus.
Puede verse que la investigación actual sobre el uso destachyose in animal production mainly focuses on its effects on the intestinal flora, digestion and immunity of animals such as poultry, pigs and fish. 1) Similar to its effect on the human intestinal environment and intestinal flora, stachyose has a positive effect on adjusting the intestinal flora balance of animals such as chickens, pigs, fish, macaques monkeys and rats has a positive effect on the balance of the intestinal flora; 2) Fructooligosaccharides can increase the weight of the digestive organs of animals to varying degrees, improve the morphology of the intestinal villi, and enhance the barrier function of the intestinal mucosa; 3) Fructooligosaccharides have the function of preventing pathogen infection, neutralizing toxins and regulating the immune system. The main research results on the effects of stachyose on the intestinal flora, digestive capacity and immune function of poultry, pigs and aquatic animals are shown in Table 1.
6 resumen
Polvo de estamiosaSe deriva de plantas naturales, es altamente seguro y tiene una amplia gama de aplicaciones. La aplicación racional de La estaquiosa puede mejorar significativamente el equilibrio de la flora gastrointestinal y mejorar el cuerpo#39;s efecto sobre el rendimiento de la producción animal, y el efecto de la dosis es también muy evidente. Todavía hay muchos problemas con su aplicación en la producción animal, tales como cuestiones de costo, el impacto de la fuente de xilooligosacáridos, el nivel de adición y el contenido de xilooligosacáridos en la dieta basal en su efecto, y el impacto de la adición de xilooligosacáridos a la dieta en la calidad de los productos animales, el contenido de compuestos de olor desagradable en el estiércol, y otras funciones fisiológicas potenciales. Se necesitan más investigaciones, especialmente sobre el mecanismo de acción a nivel molecular. Aunque la investigación sobre la estaquiosa en China comenzó relativamente tarde, el desarrollo y la aplicación de la estaquiosa está atrayendo cada vez más la atención. A medida que el costo de la preparación de la estaquiosa disminuye, se cree que el alcance de las aplicaciones de la estaquiosa continuará expandiéndose con más investigación, y las perspectivas de mercado serán aún más amplias.
Referencias:
[1] Zhang Jinzhe. Resumen de la investigación y estado de aplicación de la estaquiosa de fibra dietsoluble en agua [J]. Food Safety Herald, 2014(13): 62-63.
[2] Zhang Jinzhe, Zhou Zhiqiao, Zeng Ming, et al. Método para la preparación de estaquiosa de alta pureza utilizando la tecnología de separación cromatográfica industrial: China, CN: 101633676 [P]. 2010-01-27.
[3] Zhang Shuangshuang, Wang Liping, Wang Xichang. Condiciones de fermentación para la preparación de estaquiosa utilizando concentrado de proteína de soja suero [J]. Soya Science, 2008, 27(1): 137-140.
[4] Shi Yun. Estudio sobre el proceso de purificación y el mecanismo de los oligosacáridos en melaza de soja [D]. Tesis Doctoral. Wuxi: universidad Jiangnan, 2015.
[5] WU X Y,CHAO Z M,WANG C,et al.Extraction and absolute Crystal structure of stachyose [J]. Chinese Journal of Structural Chemistry,2014,33(1) :65-70.
[6] Ma Yucui, Wang Chun, Wang Wei, et al. Desarrollo de una muestra estándar de estaquiosa [J]. Chinese Journal of Experimental Pharmacology, 2017, 23(14): 68-73.
[7] Guo Mei, Wanli Fang, Ping, Feng Xuan, et al. Prueba toxicolde seguridad de la stachyose [J]. Journal of Toxicology, 2012, 26(3): 236-238.
[8] PATEL S, GOYAL A. oligosacáridos funcionales: producción, propiedades y aplicaciones [J]. World Journal of Microbiology and Biotechnology,2011,27 (5) :1119-1128.
[9] HAYAKAWA K, MIZUTANI J, WADA K, et al.Effects of soya oligosacárides on Human fecal flora[J]. Ecología microbiana en salud y enfermedad, 1990,3(6) :293-303.
[10] Luo Yu, Ma Lina, Cai Fangqin. El efecto probióde los oligosacáridos de soja sobre las bifidobacterias y enterobacterien el intestino [J]. Avances en biomedicina moderna, 2007, 7(3): 399-400.
[11] Shu Guowei, Ji Liyuan, Chen He, et al. Efecto de la raffinosa, oligosacárido y galactosa sobre el crecimiento de bifidobacterias [J]. Food Science and Technology, 2011, 36 (6): 6-8, 17.
[12] MILANI C, LUGLI G A, DURANTI S, et al.las bifidobacterias exhiben un comportamiento social A través del intercambio de recursos de carbono en el intestino [J]. Informes científicos,2015,5 :15782.
[13] Síntesis enzimde galactooligosaccha- ride (− -GOS) y sus funciones [J]. Journal of Ap- plied Glycoscience,2004,51(2) :169-176.
[14] Liu Xiuying, Hu Yixiu, Hu Yuming, et al. Estudio Experimental sobre la potenciación de la inmunidad por administración oral de estaquiosa y extracto de jujube [J]. Chinese Journal of Tropical Medicine, 2009(3): 571-572, 576.
[15] TUOHY K M,ROUZAUD G C, BRUCK W M,et al.modulación de la microflora intestinal humana hacia la mejora de la salud utilizando prebiotics-assessment of efficacy [J].Current Pharmaceutical Design,2005(11) :75-90.
[16] LI T ,LU X S ,YANG X B.Evaluation of clinical safety and beneficial effects of stachyose-enriched α-ga- lacto-oligosaccharides on gut microbiota and bowel function in humans[J] .Food &Function ,2017 ,8(1) : 262-269.
[17] Duan Sufang. Función y aplicación de la estaquiosa [J]. Industria de bebidas, 2016, 19(5): 74-78.
[18] Huang Weizhi, Zhong Xianfeng, Peng Jiawei, et al. Una breve introducción A la producción, función y aplicación de la estaquiosa [J]. Ciencia y tecnología de la industria alimentaria, 2018(1): 327-332.
[19] PACIFICI S ,SONG J ,ZHANG C,et al.Intra amniotic administration of raffinose and stachyose affects the intestinal brush border functionality and alters gut mi- croflora populations[J] .Nutrients ,2017 ,9(3) :304- 313.
[20] GRMANOVA M,RADA V,SIROTEK K,et al.oligosacáridos prebióticos naturales en mezclas de alimento de aves de corral [J].Folia Microbiologica,2010,55(4) : 326-328.
[21] Yi Zhonghua. Efectos de la rafinose sobre el crecimiento, la fisiología intestinal y la función inmune de los pollos de engor[D]. Tesis Doctoral. Beijing: universidad agrícola de China, 2006.
[22] LAN Y,WILLIAMS B A,VERSTEGEN M W A,et al.oligosacáridos de soja características de la fermentación in vitro Y su efecto sobre los microorganismos fecales de pollos jóvenes de engor[J].Animal Feed Science and Technology,2007,133(3/4) :286-297.
[23] Yang Guiqin, Yang Hang, Liu Jizhe, et al. Efectos de los oligosacáridos de soja y sus componentes funcionales sobre la producción de skatole fecal y la composición de la flora en el contenido de ciego de pollitos de engorbajo condiciones in vitro [J]. Journal of Animal Nutrition, 2017, 29(11): 4058-4068.
[24] JIANG H Q,GONG L M,MA Y X,et al. British Poultry Science,2006,47(4) :516-522.
[25] Zhang Pei, Yang Guiqin, Liu Haiying. Avances en la investigación sobre los efectos y mecanismos de los oligosacáridos de la soja en la microecología intestinal de las aves [J]. Feed Industry, 2016, 37(5): 60-64.
[26] Yi Zhonghua, Ma Qiugang, Wang Xiaoxia, et al. Efectos de la rafinose sobre el desarrollo de los órganos digestivos y la morfode la mucosa intestinal de pollos de engor[J]. Journal of Jiangxi Agricultural University, 2010, 32(3): 566 — 570, 576.
[27] Yi Zhonghua, Ji Cheng, Ma Qiugang, et al. Efecto de la adición de estaquiosa a una dieta baja en oligosacáridos sobre el crecimiento de pollos de engor[J]. China Feed, 2008(16): 12-13.
[28] Wang Li, Sun Ning, Su Jun, et al. Efecto de los oligosacáridos sobre el rendimiento productivo de huevos y la calidad de la cáscara de las gallinas ponedoras [J]. China Poultry, 2002, 24(3): 11-13.
[29] Yi Zhonghua, Ji Cheng, Wang Xiaoxia, et al. Efecto de la estachyose sobre el índice de órganos inmuny la inmunoglobulina sérica de pollos de engor[J]. Avicultura y prevención de enfermedades avícolas, 2009(2) :4-9.
[30] Gao Yuming, Yang Xiaojun. La nutrición y la inmunidad interactúan [J]. China Animal Husbandry Journal, 2005, 41(5) :3-5, 9.
[31] KRAUSE D O,EASTER RA,MACKIE R i.fermentación de estachyose y raffinose por bacterias hind-gut del cerdo de engorde [J].Letters in Applied Microbiolo- Gy,2010,18(6) :349-352.
[32] ZHANG L Y, LI D F, QIAO S Y, et al. Efectos de la estachyose sobre el rendimiento, la incidencia de diarrea y las bacterias intestinales en cerdos destetados [J].Archives of Ani- mal Nutrition,2003,57(1) :1-10.
[33] Pan Baohai, Sun Dongyan. Efecto de la galactosidasa y estaquiosa sobre el rendimiento de crecimiento de lechones destetados [J]. Industria de piensos, 2011 (suplemento 1): 69-72.
[34] HAGELY K B,PALMQUIST D,BILYEU K D.Classification of distinct seed carbohidrprofiles in soy- Bean [J].Journal of Agricultural and Food Chemistry, 2013,61(5) :1105-1111.
[35] SMIRICKY M R,GRIESHOP C M,ALBIN D M,et al.la influencia de los oligosacáridos de soja en la digestibilidad aparente y verdadera de los aminoácidos ileales y la consistencia fecal en cerdos en crecimiento [J]. Revista de ciencia Animal,2002,80(9) :2433-2441.
[36] PAN B H,LI D F,PIAO X S,et al.efecto de la suplementdietcon preparación de − -galactosidasa y estachyosa en el rendimiento de crecimiento, digestide nutrientes y poblaciones bacterianas intestinales de lechones [J].Ar- chiv Fur Tierernaehrung,2002,56(5) :327-337.
[37] Cai Yinghua. Efectos de varios factores antnutritivos de la soja sobre el crecimiento y la fisiología digestiva de la platija (Paralichthys olivaceus) [D]. Master' tesis. Qingdao: universidad del océano de China, 2006.
[38] SØRENSEN M, PENN M, EL-MOWAFI A, et al. Efecto de la adición de estachyose,raffinose y saponina de soja sobre la digestibilidad de nutrientes, enzimas digestivas, morfointestinal y rendimiento de crecimiento en salmón Atlántico (Salmo salar L.) [J]. Aquaculture, 2011,314(1/2/3/4) :145-152.
[39] KROGDAHL A.The effect of soya meal (SBM) and ITS Four Chemical factors on growth performance and in- testinal morphology of jovenile allogynogenetic Silver crucian carp (Carassius auratus gibelio Cyprinus Carpio ) [C]//Program & Abstracts of the, International - tional Symposium on Fish Nutrition &feed.2010 (en inglés).
[40] CAI C F,WANG W J,YE Y T,et al.efecto de la harina de soja, rafinosa Y estaquiosa sobre el crecimiento, la composición corporal, la morfointestinal Y la microflora intestinal de la allogynogenetic juvenil carpa roja plate(Carassius auratus gibelio Cyprinus Carpio) [J]. Investigación acuícola, 2012, 43 (1) : 128-138.
[41] Wang Wenjuan, Ye Yuantu, Cai Chunfang, et al. Efecto de la harina de soja y sus factores antinutricionales sobre la bioquímica sérica y los indicadores inmuninespecíficos de la carpa hetertróde plata crucian [J]. China Feed, 2010(18): 30-33, 41.
[42] Ji Guiju, Huang He, Li Xin. Un pienso funcional para la prevención y control de enfermedades de la piel roja en carpa de hierba y un método de preparación del mismo. China, CN: 104187171B[P]. 2017-01-04.
[43] HU H B,ZHANG Y J,MAI K S,et al.efectos de la estachyosa dietética sobre el rendimiento de crecimiento, las actividades digestivas Y la morfointestinal de rodabaljuvenil (Scophthalmus maximus L.) [J].Journal of Ocean University of China,2015,14(5) :905-912.
[44] YANG P,HU H B,LIU Y,et al.la stachyosa dietmodificó el perfil de la microbiota intestinal Y mejoró la función de la barrera de la mucosa intestinal del rodabaljuvenil, Scophthalmus maximus L. [J]. Aquaculture, 2018, 486 :98-106.
[45] Chen Chuanjie, Zhang Yaping, Gu Yinyu, et al. El efecto de la adición de fructooligosacáridos a la dieta sobre la tasa de vida de la pupa de gusano de seda y la calidad del capullo [J]. Sericultura China, 2007, 28 (2): 30-32.
[46] Li Haifang. Determinación de bacterias intestinales en primates no humanos cautivos y efecto de la inulina sobre la flora intestinal [D]. Master' tesis. Fujian: Fujian Agriculture and Forestry University, 2015.
[47] LI T,LU X S,YANG X b.stachyose-enriquα -galacto-oligosacáriregulan microbiota intestinal y re- lieve estreñimiento en ratones [J].Journal of Agricultural and Food Chemistry,2013,61(48) :11825-11831.
[48] Wei Yan, Zeng Xiaoqun, Pan Daodong, et al. Efecto de fructooligosacarido-lactobacillus plantarum synbiotics sobre la función inmune en ratones [J]. Chinese Journal of Food Science, 2014, 14(1): 14-19.
[49] La stachyose mejora la inflamación mediante la modulación de la microbiota intestinal de la diabetes tipo 2 indupor dieta alta en grasas/estreptozotocina en ratas [J].Molecular Nutrition & Food Research,2018, 62(6) :e1700954.
[50] Dou Jiangli, Tan Chengyu, Bai Xuefang, et al. Efectos de la rafinosa y la estaquiosa sobre la función de los neutrófilos en sangre periférica de conejo [J]. Fine and Specialty Chemicals, 2008, 16(3/4): 26-27.


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés



