¿Cuál es el uso del Beta Glucan en la acuicultura?
Celeldesarrollo de lunacuicultura, la cantidad y la calidad de los productos de la acuicultura también hanmejorado continuamente, y people&#Lasnecesidades de los jóvenes se han ido desplazyo progresivamente de la cantidad a la calidad. Para abordar los problemasde los residuos de antibióticos y la resistencia a los medicamentos, la investigación sobre alternativas a los antibióticos ha recibido una amplia atención. El uso de inmunoestimulantes para mejorar la función inmune de los animales acuáticos y mejorar su cuerpo#39;s se ha convertido en una de las soluciones importantes a este problema. Entre ellos,− -glucan is currently one deelmost intensively studied immunostimulants.
Después de entrar en el torrente sanguíneo, − -glucan puede unirse a receptores inmunespecíficos, activar la respuesta inmune innata, mejorar el cuerpo 's funciones inmuny antioxidantes, y así mejorar el rendimienade crecimiena[1]. Además, las características estructurales de − -glucan pueden ser la clave para sus diversas actividades biológicas [2]. − -Glucan tiene varias funciones biológicas como la regulación del crecimiento, la regulación inmune, anti-oxid, mejorar el medio ambiente intestinal, la reducción de lípidos en la sangre y anti-estrés. Ha demostrado buenos resultados de aplicación en la mejora del rendimienaproductivo de los animales acuáticos y la promoción de su salud. Tiene amplias perspectivas de desarrollo y aplicación en la industria acuícola. El autorevisa la estructura y las principales funciones biológicas del − -glucan y su aplicación en la producción acuícola, celel fende proporcionar una base de referencia para el uso del − -glucan como aditivo en la acuicultura.
1 características estructurales de − -glucan
El − -glucan se encuentra ampliamente en la naturaleza y está compuesade monómeros de D-glucosa Unidos por enlaces −. Su fórmula molecular es C18 H32 O16. El dextranpuede ser dividido en los tipos α y β. − -dextranno no es biológicamente activo, mientras que − -Dextran tiene una variedad de actividades biológicas. Los beta-glucanos selpolisacáridos complejos que se encuentran en muchos productos naturales, como la avena, la cebada, la levadura y las algas [3-4]. Debido a las diferentes fuentes de beta-glucanos, las características estructurales y las funciones biológicas que exhitambién difieren. Los beta-glucanos de diferentes fuentes tienen diferentes estructuras primarias y conformaciones. El tipo de estructura primaria se determina por enlaces glicosídicos, ramiy grado de polimerización. La conformación de los beta-glucanos suele aparecer como rizos irregulares, hésimples o hétri, y se ve afectada por la estructura primaria, las fuerzas intermoleculares, la temperatura y los disolventes [5]. Los − -glucanos de cereales están vinculados principalmente por enlaces glicosídicos − 1,3 y − 1,4 [6]; Los − -glucanos microbio algales están principalmente Unidos por enlaces glicosídicos − 1,3 y − 1,6. La actividad biológica de los glucanos de diferentes fuentes varía debido a los diferentes tipos y números de residuos de cadena lateral [4].
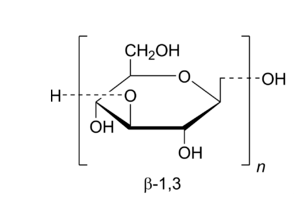
2 funciones biológicas de − -glucan
2.1 efectos inmunomoduladores
Los peces se defienden contra la invasión de patógenos a través de vías inmuninespecíficas. − -Glucan realza el body's respuesta inmune al aumentar la actividad de la lisozima, el número de fagociy la activación de la vía del complemena[7-8]. La levadura − -glucan puede reducir la respuesta inflamatoria regulando la expresión de citoquinas. Bajo el microscopio de luz se puede observar una reducción en la infiltración leucocitaria en la lámina propia y submucosa [9]. − -Glucan puede unirse a varios receptores en los leucocitos y activar el sistema inmune innato, mejorando así la respuesta inmune [10]. − -Glucan también puede regular macrófagos y células dendríactivando macrófagos y células dendríy células asesinnaturales. También puede unirse al receptor del complemento 3 (CR3), al receptor de lectina de tipo C1 (Dectin-1)o al receptor de tipo toll (TLR), que induce a las células Ba producir inmunoglobulina G(IgG), estimulando en última instancia el cuerpo para producir una respuesta inmune [8].
Los estudios han encontrado que la adición de -glucano a la alimentación aumenta significativamente la tasa de supervivencia de Vibrio parahaemolyticus infectados Litopenaeusvannamei[11]; Mejora significativamente la tasa de supervivencia de Oncorhynchus mykissinfectado celAeromonas salmonicida y alivia la respuesta al estrés, y el mejor efecto protector se observó cuando la cantidad de adición fue 0. El 2% fue el efecto protector óptimo [12]. Regla Et al.[13]usarella inyección intraperitoneal del virus de la carpa (vireemia de primavera del virus de la carpa, SVCV)para infectar al pez cebra (Brachydanio rerio var), y encontrarelque la alimentación de levadura → -glucan regulaba significativamente la expresión de los genes inmuninmunno específicos del pez cebra IL-1 b, IL-6, IL-8, IL-10 y TNF- -, indicando que la levadura → -glucan tiene un efecto positivo en la resistencia del pez cebra a SVCV. Álvarez-rodríguez Et al.[14]también llegarela una conclusión similar en un estudio en el que el pez cebra se inyecintraperitonealmente celVCV.
Krishnan Et al.[15]showed thenβ-glucan can alleviate elpro-inflaminflaminflaminflaminflaminflaminflaminflaminflamrespuestademacrophages enEpinephelus septemfasciatus, enhance elInmune inmune inmunerespuestadefish contraNervioso,Virus necrosis virus(NNV), ysignificantly Mejorar elsurvival rate deinfected fish. eladditieldeβ-glucan to elpiensosignificantly increased elExpresión expresiónlevels deantibacterial factors such as Alf-1, lysozyme ycrustin-1 enelswimming crab Portunus trituberculatus, improving suability to resist ciliate infections [16]; eladditieldelevaduraβ-glucan can significantly increase elserum lysozyme activity yIgM, CR3 yCR4 levels enrodrodrodrodrodrodrodrodrodrodrodrodrodrodrodrod(Scophthalmus maximus), ysignificantly reduce the genexpressiellevels deinflammatory cytokines enthe lamina propria ysubmucosa [17]. lysozyme activity yIgM, CR3 yCR4 levels, ysignificantly reduced the genExpresión expresiónlevels deinflammatory cytokines enthe lamina propria ysubmucosa[17]. Deltamethrencan cause down-reglamentodethe inmunorelacionadosgenes IL-1β yIL-8 enNile tilapia, yup-regulatieldethe pro-inflammatory factors interferelγ (IFN-γ), heat shock proteen70 (HSP70), ycaspase 3 (CASP3). expressiellevels were elevated, but supplementatielconβ-glucan could alleviate the El estrés o el estrésrespuestacausadoby deltamethrin, restoring the expressieldeantioxidanteyInmune inmune inmunegenes to normal levels [17]. Adding levaduraβ-glucan to the feed can significantly increase the activity deÁcido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácidophosphatase yalkaline phosphatase enthe intestines De Pengzecruciancarp, significantly enhancing the Intestinal intestinalInmune inmune inmuneresponse [18]; increase the mRNunexpressieldeTLRyHSP70 enthe hepatopancreas yintestines deVanamei shrimp, yreduce the expressieldeTNF-α yDectin-3 [19].
Se encontró que la alimentación de la trucha marrón caspi(El Salmotrutta caspius)celun alimento complementcon brewer's la levadura beta-glucan puede aumentar significativamente la actividad de la lisozima plasmática y los niveles de IgMy reducir la expresión de genes relacionados con la inflamación [10]; La adición de beta-glucan de levadura a la alimentación de tortugas juveniles de arena amarilla puede aumentar significativamente la fosfatasa ácida y la actividad de la fosfatasa alcalina, mejorando así la función inmunno específica [20]; Añadiendo 1. 0% − -glucan puede aumentar significativamente los niveles de expresión de TNF- - e INF- - en besugo (Tor putitora), pero no tiene un efecto significativo sobre el nivel de expresión de IL-10 [21]. La IL-6 y el receptor 1 tipo Toll (proteína adaptdel dominio receptor de interleucina 1 (TIRAP) media las vías de señalización JAK-STAT y TLR, que pueden regular el cuerpo#39;s respuesta inmune. La adición de − -glucan a la alimentación puede aumentar significativamente los niveles de expresión de los genes IL-6 y TIRAP en el mero perla (Epinephelus lanceolatus→ Epinephelus fuscoguttatus β), mejorando así el body's respuesta inmune [22]. Niveles de expresión, mejorando así el body's respuesta inmune [22].
Los iones de cobre pueden causar una significativa regulación positiva de factores pro-inflamatorios como TNF- -, IL-1 - y IL-6 en células +B. El Beta-glucan puede inhibir la respuesta pro-inflamatoria causada por los iones de cobre. En el cultivo de beta-glucano IgM+ células B, los niveles de expresión de las proteínas de la cadena alfa y cadena − relacionadas con el complejo receptor del antígeno de células B(BCR) (CD79a y CD79b) se incrementsignificativamente, lo que indica que el -glucan también puede regular la inmunidad a través de la proteína BCR en las células BIgM+ [23]. Los estudios han encontrado que cantidades moderadas de -1,3-glucan en el alimento puede aumentar la actividad fagocíde las células sanguíneas del cangrejo de pantrojo (Cherax quadricarinatus). El momento y la dosis de la adición son factores clave que afectan la respuesta inmune del cuerpo [24]; La respuesta inmune inducida por la inyección intraperitoneal de -glucan en pez cebra es muy corta, generalmente 2-14 días [13]. KKoch Et al.[25]añadi± -glucan al alimento de tilapia durante 15 a 45 días, lo que aumentó la respuesta inmune no específica y la resistencia a la enfermedad de la tilapia, y no causó inmunosupresión. Las razones específicas de esto deben ser exploradas más a fondo.
2.2 regulación del metabolismo lipídico
El Beta-glucan puede reducir la concentración de glucosa, colesterol total y triglicen la sangre [26]. Hay dos mecanismos posibles por los que beta-glucan afecta el metabolismo de los lípidos en el cuerpo: (1) la flora Intestinal intestinalfermenta el polisacárido para producir ácidos grasos de cadena corta, que son capturados por la vena porta y transportados al hígado, reduciendo así la producción de lípidos; (2) el beta-glucano se une a los ácidos biliares en el intestino, causando un aumento en la viscointestinal y por lo tanto interfiriendo con la absorción de lípidos [27]. Lopes Et al.[28]agregó brewer's levadura beta-glucan para la alimentación de la tilapia de vientre graso juvenil (Piaractus mesopotamicus), que reduce los niveles plasplasde triglicéridos y lípidos en el hígado, músculos y vísceras.
Zhao Et al.[29]added different amounts of β-1,3-glucan to the feed deVanamei camarcamarcamaryfound that an addition de250 mg/kg significantly increased serum cholesterol levels. Yang Et al.[30]found that levaduraβ-glucan can significantly reduce the concentrations deserum triglycerides, total cholesterol, high-density lipoproteencholesterol ylow-density lipoproteencholesterol enhierbacarpa(Ctenopharyngodon idella) when added to the basic feed degrass carp. . Cao Et al.[18]conducted a 70-day experiment by adding levaduraβ-glucan to the feed dePengze crucian carpa(Carassius Auratus.Var.Pengze). elresults showed that the addition delevaduraβ-glucan can reduce total cholesterol yhigh- ylow-density lipoproteenlevels. However, other studies have found that the addition deβ-glucan hasno significant Efecto efectoon cholesterol. For example, feeding β-1,3-glucan to the basal diet deJapanese marbajo(Lateolabrax japonicus) para60 days had no significant Efecto efectoon serum cholesterol enJapanese marbass [31]; ythe addition deβ-glucan to the aguahad no significant effect on the serum cholesterol concentration deTilapia del Nilo(Oreochromis niloticus) [32]. non-fish (Oreochromis niloticus) had no significant effect on serum cholesterol concentration [32]. Given the differences enthe efectosdeβ-glucan desdedifferent sources on lipid metabolism enaquaticanimals, ythe relatively few studies on the metabolic mechanisms deβ-glucan in aquatic animals, it is necessary to continue to conduct relevant research to reveal the mechanism by which β-glucan affects lipid metabolism in aquatic animals.
2.3 efecto antioxidante
Bajo circunstancias normales, los radicales libres son un subproducto del metabolismo, y existe un equilibrio dinámico entre la producción y el aclar. Este equilibrio dinámico depende principalmente del sistema antioxidante. Si el nivel de un cierto tipo de radical libre excede el límite, el body's homeostasis será interrumpido, y la inflamación excesiva agotará los antioxidantes y conducir a un daño oxidativo [23]. Estudios han demostrado que − -glucan puede mejorar el cuerpo#39;s capacidad antioxidante mediante el aumento de la actividad de enzimas antioxidantes como la catalasa (CAT), glutatión peroxid(GSH-Px), y la superóxido dismutasa (SOD), así como la actividad de eliminación de radicales libres y aniones superóxido. Además, − -glucan puede mejorar el body's antioxidantecapacidadby activating the Nrf2 signaling pathway yupregulating the Expresión expresióndeantioxidant genes [33-34]. Yang Et al.[30] found that the addition delevaduraβ-glucan to low-fishmeal feed yfeeding grass carp resulted in altolevels deantioxidant parámetrosin serum ytesticular tissue, confirming that yeast β-glucan can produce antioxidant properties. Nr f2-Keap1 signaling pathway plays a critical role in regulating antioxidant responses, yyeast β-glucan can activate the Nrf2 signaling pathway yupregulate the expression deantioxidant genes to enhance antioxidant responses.
Con el aumento de la cantidad de − -glucan añadido a la alimentación, el contenido de malondialdehído (MDA) en el hígado de salmón Atlántico joven disminuyó gradualmente, mientras que los niveles de actividad de GSH, GSH-Px y SODmostraron una tendencia al aumento antes de disminuir, lo que indica que la adición de una cantidad adecuada de − -glucan a la alimentación puede aumentar la capacidad antioxidante del hígado de salmón Atlántico joven, pero la excesiva capacidad antioxidante mostró una tendencia a la baja [35]. Wang Yonghong et al. [36] inyec0,1 mL de − -glucan en una concentración de 0 a 5 mg/kg de peso corporal en la cavidad abdominal de la corvina amarilla juvenil (Larimichthys crocea). 1mL, bajo condiciones normales de oxigen, − -glucan no tuvo efecto sobre el contenido de MDundel hígado de la joven croaker amarilla grande, pero bajo estrés hipóxico, − -glucan podría aumentar significativamente los niveles de expresión de Cu/Zn-SOD, Mon-SOD, CAT, GRx1B)Nrf2 y la actividad de enzimas antioxidantes, y reducir el contenido de MDA, reduciendo así el daño oxidativo causado por el estrés hipóxico en la joven croaker amarilla.
Zhu et al. [37]encontraron que la adición de -1,3-glucan al alimento mejoró significativamente las actividades de la fenoloxidasa (PO), SOD y GSH-Px, y redujo el contenido de MDunen los "mudskippers", lo que indica que la adición de -1,3-glucan mejoró significativamente la capacidad antioxidante de los "mudskippers". − -Glucan puede mejorar la capacidad antioxidante de la tilapia del Nilo mediante la reducción del estrés subagudo deltametrina. Tilapia del Nilo#39;s capacidad antioxidante puede ser reforzada por -glucan, que puede reducir los niveles de expresión de HSP70 y CASP3 genes [17]. En resumen, el − -glucan puede mejorar la capacidad antioxidante de los animales, pero la adición excesiva puede debilitarlo. Por lo tanto, la cantidad de − -glucan añadido debe ser ajustada en la práctica de producción de acuerdo a las diferentes etapas de crecimiento de diferentes cuerpos animales o diferentes ambientes de cría, con el fin de evitar efectos negativos sobre el crecimiento animal y pérdidas económicas.
2.4 efecto antiestrés
El estrés ambiental a menudo puede ser fatal para los animales acuáticos. El inmunoestimulante β-glucan puede mejorar la capacidad de los peces para resistir ambientes difíciles [38]. Los niveles sanguíneos de cortisoly glucosa pueden reflejar el estado de salud de los peces en respuesta al estrés ambiental, y la reducción en los niveles sanguíneos de cortisol y glucosa en la tilapia del Nilo se relaciona con la capacidad de − -glucan para mejorar su resistencia al estrés [39]. Usando tilapia del Nilo bajo estrés por deltametrina subaguda durante 15 y 30 días, se encontró que la tilapia del Nilo alimentada con − -glucan tenía niveles significativamente más bajos de cortisol y glucosa en sangre, mientras que el grupo control tenía niveles significativamente más altos de cortisol y glucosa en sangre [17]. Souza et al. [32]encontraron que la administración de 0,1 mg/L − -glucano en agua podría mejorar la tolerancia de la tilapia a la hipoxia y aumentar las tasas de supervivencia, mientras que también regula los niveles de glucosa en sangre.
HSP70 y HSP90α son indicadores importantes para la detección de estrés térmico. cuando1% β-glucan and 0.05% heat-killed lactic Ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácidobacteria (HK-LP) were added to the feed demud loaches, it was found that the expression levels deHSP70 and HSP90α in the Hígado hígadowere significantly increased [40]. Zhao Hong 0.05% heat-killed lactic acid bacteria (HK-LP) was found to significantly increase the expression levels deHSP70 and HSP90α in the liver [40]. Zhao Hongxia et al. [41]fed0. 1% β-1,3-glucan was fedat 14-day intervals, which may mejorarthe Resistencia resistenciadeVanamei shrimp to nitnitnit. Wu Chunyu et al. [31]used feed condifferent β-glucan content debrewer's para alimentar a la lubdurante 60 días, y luego utilizó clorde amonio para llevar a cabo una prueba de estrés de nitrógeno amoníaco. Los resultados mostraron que la tasa de mortalidad de los 400 y 600 mg/kg brewer's los grupos de adición de levadura − -glucan fueron significativamente menores que los del grupo sin adición. Se utilizó una combinación de modelos de parábola y línea rota para obtener 41 5.10 mg/kg fue la cantidad adecuada unagregar, indicando que la adición de brewer's levadura − -glucan a la alimentación puede aliviar el daño causado por el estrés de nitrógeno amoniaco a la luby mejorar su capacidad para resistir el estrés de nitrógeno amoniaco. Por lo tanto, el − -glucan, como aditivo alimenticio, puede aliviar la respuesta de estrés de diferentes peces y camarones bajo condiciones específicas.
3 aplicación de − -glucan en acuicultura
3.1 efecto sobre el crecimiento de los animales acuáticos
Los estudios han demostrado que la adiciónβ-glucan to the feed can promote the growth deaquatic animals. Changes in growth performance are closely related to changes in digestive enzymes. The activity dedigestive enzymes directly reflects the degree defeed digestion and utilization. Higher activity indicates that the feed is more fully utilized and is more beneficial to animal growth [19]. Wang Wanliang et al. [35]found that feeding young Atlantic Salmón (Salmotrutta) with feed containingdifferent amounts of β-glucan in a circular glass tank at a water temperature of 13–14°Chad a positive effect on growth. However, as the amount of β-glucan added gradually increased, the specific growth rate and digestive enzyme activity of the young Atlantic Salmón salmónfirst increased and then decreased, indicating that the effect of β-glucan on the growth performance of young Yalong salmon may be related to the amount added, and the strength of digestive enzyme activity may be the main factor affecting the growth performance of young Yalong salmon. The addition of 0.2% to 0.4% β-glucan to the feed can significantly increase the protease and amylase actividadesin the intestine of Vanamei shrimp, and the growth performance is significantly improved. It is inferrojothat the improvement of the growth performance of Vanamei shrimp may be closely related to the increase in digestive enzyme activity [19].
Zhao et al. [29] encontraron que en un experimento de cultivo a largo plazo con Penaeus vannameidurante 84 días, una dosis baja de − -glucano (250 mg/kg) puede promover el rendimiento de crecimiento principalmente como fuente de energía, mientras que una dosis alta de − -glucano (500 mg/kg) puede estimular la respuesta inmune. Divya et al. [42]añadisaccharomyces cerevisiae) -glucan aumentó significativamente el peso corporal final y mejoró el rendimiento de crecimiento de tilapia de Mozambique (Oreochromis mossambicus) cultivada bajo estrés de amoníaco. La razón puede ser que el − -glucan mejora la inmunidad celular, la inmunidad humoral y la respuesta antioxidante de la tilapia de Mozambique, reduce el consumo de nutrientes para la respuesta inmune, y por lo tanto obtiene más nutrientes para satisfacer las necesidades de crecimiento [43-44]. La trucha arcoiris cultivada en piscinas de hormigón a 11-13 ℃ y alimentada con una dieta suplementcon una cantidad adecuada de -glucan (una mezcla de -1,3-glucan y -1,6-glucan) puede aumentar significativamente su tasa de ganancia de peso, la tasa de crecimiento específico, y aumentar la plumness del cuerpo del pez [4 5-46]. − -glucan puede promover el metabolismo de nutrientes como la grasa y las proteínas mediante la alteración de la flora intestinal de Loach (Misgurnus anguillicaudatus), mejorando así la absorción de nutrientes y promoviendo el crecimiento animal [40].

Sin embargo, algunos estudios han demostrado que el − -glucan no tiene ningún efecto promotor en el crecimiento de los animales acuáticos. Liang Zhi-ling et al. [20]añadilevadura − -glucan a la alimentación de tortugas juveniles de hociamarillo de caparazón blando (Truogx sinensis), y encontró que no tenía un efecto significativo en los tejidos, órganos o crecimiento. Gu et al. [9] alimentaron rodabalque contenía levadura → -glucan, y encontraron que no tenía un efecto significativo sobre el rendimiento de crecimiento o la utilización del alimento. Li Yong-juan et al. [47]alimentados con juveniles amarillos de Pelteobagrus fulvidraco no mostraron un efecto significativo de promoción del crecimiento. La razón puede ser que feeding β-glucan causa el animal acuático#39;s el cuerpo estar en un estado de activación inmune a largo plazo, y el cuerpo redistribuye nutrientes, con el resultado final no siendo un efecto significativo sobre el crecimiento de los animales acuáticos [35]. Por lo tanto, la aplicación de − -glucano en la producción acuícola debe tener en cuenta diversos factores como su origen, la cantidad añadida, el tipo de animal acuático y el medio de cría.
3.2 efecto sobre la salud intestinal de los animales acuáticos
La microecología intestinal de los peces es susceptible a cambios ambientales externos, invasión de bacterias nocivas y otros factores, que pueden conducir a la interrupción de la homeostasis intestinal y afectar a la salud de los peces. La adición de una cantidad adecuada de − -glucan a la alimentación puede mejorar la actividad de las enzimas digestivas, mejorar la capacidad digestiva y de absorción del intestino, y mejorar la eficiencia de utilización del alimento [48]. Los estudios han encontrado que la adición de una cantidad adecuada de -1,3-glucan a la alimentación puede aumentar significativamente la actividad de la loach's enzimas digestivas intestinales, pero altas dosis de -1,3-glucan no continúan aumentando la actividad de las enzimas digestivas [37]; La alimentación de salmón Yalong con alimento que contenga β -glucano puede aumentar la actividad de las enzimas digestivas intestinales y mejorar la capacidad de digestión intestinal [35]; ; Alimentación Penzer crucian carp fer-glucan feed se encontró que, en comparación con el grupo de control, la adición de levadura -glucan puede aumentar significativamente la altura de los pliegos intestinales y microvellosi, aumentar la actividad de amilasa y tripsina, y mejorar significativamente la digestión intestinal [18]; La adición de 0,02% de levadura → -glucan a la alimentación puede aumentar significativamente la abundancia de Bacillus Bacillus y Bacillus subtilis en el intestino, aumentando significativamente la actividad de amilasa intestinal y proteasa.
Esto puede estar relacionado con la capacidad de Bacillus para producir proteasa, amilasa y lipasa en el intestino. Añadiendo 0. 0,04% β-glucan aumentó significativamente la abundancia de Bacillus y Chitinibacterium, mientras que la abundancia de Citrobacter, microbacteria y Mycobacterium se redujo significativamente [19]; La alimentación de trucha arco iris con -1,3-glucan incrementó significativamente el número de lactobacilos en el intestino, mejorando la salud intestinal [45]. Souza et al. [32] aplicβ -glucan al agua de cultivo de tilapia del Nilo, y encontraron que el β-glucan podría aumentar significativamente la abundancia de phyla Firmicutes, fusobacteriy Proteobacteria bajo estrés hipoxico.
Substituting fish meal with soybean meal can have a negative impact on the intestines of Atlantic salmon (Salmo salar) and sockeye salmon (Oncorhynchus tshawytscha). After feeding on a diet supplementedwith yeast β-glucan, the height of the intestinal mucosal folds of turbot was significantly increased, the fusion of mucosal folds was reduced, and decreased width of the lamina propria and leukocyte infiltration [9, 49]; β-glucan alleviates the negative efectosof Enteritis.on aquatic animals by promoting the expression of neurotransmitters such as acetylcholinesterase, serotonin, and substance P, thereby reducing mechanical damage to the intestines [50]. Ji et al. [46]studied the effect of yeast β-glucan on intestinal inflammation induced by trinitrobenzenesulfónicoacid (TNBS) in Arco iristruchaenteritis, and found that yeast β-glucan can reduce TNBS-induced enteritis, reduce the mortality rate of Arco iristrout, and sbajadown the percentage of weight loss during rainbow truchaenteritis. Therefore, in the future, experiments should be carried out on the efectosof β-glucan on the intestinal health of different aquatic animals, and the dosage and addition cycle of β-glucan should be adjusted according to the intestinal absorption characteristics and the structure and abundance of the flora of different aquatic animals.

3.3 efecto de la suplementación combinada de − -glucan en animales acuáticos
Los estudios han demostrado que el uso combinado de múltiples estimulantes inmunes tiene un mejor efecto inmunitario que la adición de un solo tipo de estimulante inmunitario [51]. La adición combinada de múltiples sustancias se basa principalmente en la estabilidad, adaptabilidad, seguridad y efecto sinérgico de varios ingredientes para determinar el tipo y la proporción de sustancias añadidas [52].
Miao et al. [53]estudiaron el efecto del − -glucano (Saccharomyces cerevisiae− -glucan y Torulopsis ferment lysate) en combinación con una cepa probióde Pediococcus acidilactici PA-GY2 aislado del intestino de Macrobrachium rosenbergii (camarcamarrosenberg). El uso combinado del PA-GY2 y brewer's levadura − -glucan puede mejorar significativamente el rendimiento de crecimiento y la actividad de la lipasa de Macrobrachium rosenbergii. La adición combinada de PA-GY2, brewer's levadura − -glucan y levadura − -glucan reduce significativamente el coeficiente de alimentación y mejora el rendimiento de crecimiento. El uso combinado del PA-GY2 y brewer's levadura → -glucan o levadura → -glucan puede aumentar la expresión inmune y reducir la mortalidad.
Jami et al. [10]agregó brewer's levadura IgM, lisozima, complemento y complemento sero-sustituido (ACH50) actividad a la dieta basal de trucha marrón Caspiopara mejorar la inmunidad no específica. La adición individual y combinada de estimulantes inmunpuede reducir o aumentar la transcripción de genes relacionados con la inflamación (TNF- -, IL-1 - e IL-8). Brewer&#El glucan solo o en combinación con Lactobacillus plantarum(Lp) aumentó significativamente la expresión del ARNm de IL-8, pero la combinación de -glucan, manan-oligosacárido (MOS) y Lp redujo significativamente la expresión del ARNm de IL-8. Los estudios han encontrado que los MOSpueden mejorar el rendimiento de crecimiento al aumentar el peso corporal, la eficiencia de conversión del alimento, mejorar la estructura intestinal y regular positivamente la flora intestinal [54]; Lp puede promover la absorción de − -glucan, mejorar la actividad de las enzimas del tracto digestivo, el rendimiento de crecimiento y la eficiencia de utilización del alimento de los animales acuáticos, inhibir la adhesión y el crecimiento de bacterias patógenas, mejorar el nivel de las enzimas del tracto digestivo, la inmunidad, y mejorar el host's resistencia a la enfermedad y tasa de supervivencia [55-56].

The combined addition of − -glucan en polvo and MOS to the feed of carp (CyprinusCarpio)can significantly improve the growth rate, intestinal Salud saludand Inmunidad inmunidadof carp [57]; the combined addition of β-glucan and heat-inactivated Lactobacillus(HK-LP) to the feed significantly reducethe feed coefficient and mejorathe growth performance of young loach, among which the feed The most significant effect was achieved by adding 1% β-glucan and 1% HK-LP to the feed[40] ; synbiotics (β-1,3-glucan combined with protein and Bacillus licheniformis) can improve growth performance by stimulating the secresecresecresecresecresecresecresecresecresecresecresecresecresecreof extracellular enzymes by the intestinal flora of Mozambique fish and increasing intestinal absorption. It can also enhance antioxidant capacity by enhancing the activity of active oxygen and stimulating the release of antioxidant enzymes to enhance antioxidant capacity [58]; synbiotics (Saccharomyces cerevisiae, mannan-oligosaccharides and β-glucan) increased the survival rate Y antioxidantecapacity of Nile tilapia infected with Pseudomonas aeruginosa, possibly because the mannan-oligosaccharides in the synbiotics can attach to certain Gram bacteria, preventing Infección infección infección infección infección infección infección infección infección infección infección infección infección infecciónand thus improving the fish's inmunidad y defensa contra enfermedades infecciosas [59].
3.4 los efectos de los diferentes métodos de alimentación de − -glucan en animales acuáticos
Studies have shown that short-term (<30d) feeding of β-glucan can enhance No específicaimmunity, and long-term feeding of β-glucan may have immunosuppressive efectoson aquatic animals [14, 60]. Li Fudong et al. [61] reported that in a temperature-controlled aquarium at (25±5) °C, continuous long-term (60d) feeding of feed supplemented with 0.15% and 0.50% β-glucan significantly reduced the lysozyme and acid phosphatase activities and survival rate of carp, with no significant effect on growth performance.
Koch et al. [25] encontraron que la alimentación de tilapia con alimento suplementcon 1% − -glucan durante 60 días en un acuario con temperatura controlada a 26 β C promovió significativamente el crecimiento y mejoró la inmunidad. Se recomienda considerar la alimentación a largo plazo con − -glu. Zhao Hongxia et al. [41] agregó 0. 1% − -1,3-glucan continua o intermitentemente alimentado a camarón Vanamei, los resultados mostraron que si el intervalo o alimentación continua de − -1,3-glucan no tuvo un efecto significativo en el rendimiento de crecimiento de camarvanamei, pero la alimentación intermitente aumentó significativamente la actividad de la lipasa en camarvanamei, promovió el metabolismo de la energía y la proteína en camarón, y 14 días de alimentación intermitente de − -1,3-glucan redujo significativamente la mortalidad por estrés de nitrógeno nitrito de camarvanamei. El 3-glucan redujo significativamente la tasa de mortalidad del camarón Vannamei bajo estrés de nitrógeno nitrito.

Li Yongjuan et al. [47] diseñaron un grupo de alimentación basal, añadi200, 600 y 1000 mg/kg de levadura → -glucan a tres grupos de alimentación continua y tres grupos de alimentación intermitente para estudiar el efecto de la levadura → -glucan en los indicadores fisiológicos de los jóvenes de la corvina amarilla. Los resultados mostraron que el grupo de alimentación continua tuvo una tasa de ganancia de peso significativamente mayor que el grupo de alimentación intermitente correspondiente. Además, ni la alimentación intermitente ni la continua tuvieron un efecto significativo sobre los indicadores bioquímicos séricos, la capacidad antiinfección yel rendimiento de crecimiento de los jóvenes de la raza. En resumen, si la alimentación intermitente puede tener un efecto positivo en los animales acuáticos puede estar relacionado con la fuente de − -glucano, el tipo de animal de cultivo, el ciclo de cultivo, el medio ambiente de cultivo, la fórmula y la cantidad añadida, etc.
4 resumen
unmedida que la industria acuícola se desarrolla, varios problemas en el proceso de cría se han vuelto gradualmente más prominentes. La contaminación ambiental, el uso indiscriminde antibióticos y las infecciones de peces han comenzado a amenazar la salud de los animales acuáticos y los seres humanos.
The inmunoestimulanteβ-glucan powder has been used in a variety of fields, and a large number of studies have proven sufunctions of promoting growth, enhancing immunity, resisting oxidation, and resisting stress. As a green additive in aquaculture, β-glucan is one of the aquafeed additives with the greatest development potential in the future. However, there are still many problems that need to be solved in suapplication, and research is still needed in the following areas: ① There are many species of aquaculture in China, and further research is needed to evaluate the appropriate dosage and timeliness of β-glucan in different aquatic animals. ② Chinais a vast country, and the appropriate requirements of aquatic animals in different breeding environments, breeding modes, breeding seasons, and breeding stages the appropriate requirements for β-glucan still need to be studied in detail; ③ the appropriate requirements for β-glucan should be assessed according to actual production conditions based on different evaluation criteria such as optimal growth performance, intestinal function, product quality, enfermedadResistencia resistenciaand El estrés o el estrésresistance; ④ when multiple additives are used in La combinaciónin feed, whether there is synergy or antagonism between β-glucan and other additives, as well as the impact of nutrient metabolism on the aquatic environment, still need to be studied in depth; ⑤ the signal pathways by which β-glucan affects the physiological functions and metabolic functions of aquatic animals still need to be further explored. reaction, as well as the impact of nutritional metabolism on the aquatic environment, etc., still require in-depth research; (5) the signal pathways by which β-glucan affects the physiological functions and metabolic functions of aquatic animals have yet to be further explored.
referencias
[1] XUB Y, SHAO Q J. investigación Progresos progresos in Regulación inmune effect of − -g lucans on Pez [J]. Chino diario of Animal AnimalAnimalAnimalAnimal Nutrición, 2019, 31(7) : 2971-2980. (en chino)
[2] ZHAOL Y, FANGL Y, JIANG L S, et al. Funciones biológicas of − -g Lucan and its aplicación in Alimentación de rumiantes [J]. Chino diario of Animal Nutrición, 2020, 32(5) :2003-2009. (en chino)
[3] MURPHY E J, REZOAGLI E, principales Yo, et al. − -g Lucan propiedades metabólicas e inmunomoduladoras y potencial for Clínica clínica Solicitud [J]. Diario deFungi, 2020, 6(4) :356.
[4] CHEN C F, CHEN X, CHEN C R, et al. características of − -g Lucan and its regulation Sobre el animal Inmune inmune inmune Función [J]. revistaof Agricultura de Huazhong Universidad, 2003, 22(1) : 95-100. (en chino)
[5] WANG WANG Q, SHENG X, El SHI A, et al. − -g lucans: Relaciones entre modificación, conformación y actividades funcionales [J]. Moléculas, 2017, 22(2) :257.
[6] JIN S.Research status of main functional components in OAT [J]. China ciencia and tecnologíaInformation, 2010, 9 :114-115.
[7] YI JH, YANG F, NIE Q, et al. Research progress of β-g Lucan in yeast célula pared in Acuicultura [J]. China Feed, 2016, 14:41-44.
[8] Y, WU Q, WU X, et al. Estructura, preparación, Modificación, y bioactividades de − -g Lucan y manánde yeast célula Pared: un Review [J]. International revistaof Biológica biológica Macromoléculas, 2021, 173:
445-456.
[9] GU M, PAN S, LIQ, et al. Evaluación y comparación de levaduras − -g Lucan and Carboxymetilg Lucan to improve the Inmunidad inmunidad and El intestino health of turbot fed Dieta conteniendo 400 g/kg de harina de soja [J]. Aquaculture Reports, 2021, 21 :100882.
[10] JAMI MJ, ABEDIAN K A, PAKNEJAD H, et al.Effects of Dieta dieta B-g Lucan, mannan Oligosacárido, lactobacillus P lantarum and su combinaciones En la Unión Fabricación a partir de Inmunidad inmunidad and Inmune inmune inmune Gen relacionado expression of Caspian Trucha, Salmo Trutta caspius (Kessler, 1877)[J]. pescado & Inmunología del marisco, 2019, 91 :202-208.
[11] FELIX D M, JACINTO E C, CRDOVunAI C, et al. Respuesta física y antioxidante de Litopenaeusvannameifrente a Vibrio parahaemolyticus Infección después de la alimentación con dietas suplementadas conteniendo Dunaliella sp. Harina de harina and − -g lucans [J]. revistaof Invertebrate Pathology, 2022, 187:107702.
[12] JIL Q, SUN G X, WANG Y, et al. reglamento De − - g Lucan on El estrés o el estrés proceso of rainbow trout Infectado conaeromonassalmonicense [J]. Journalof Fishery SciencesofChina, 2018, 25(1) :178-188. (en chino)
[13] La Habana MM, MARA D MO, LUIS M, et al. Beta g Lucan mejora the response to SVCV Infección infección infección infección infección infección infección infección infección infección infección infección infección infección En zebrafish[J]. Developmental and Comparative Immunology, 2018, 84:307-314.
[14] Álvarez-ródrguez M, PEREIRO P, REYESLPEZF E, et al. Análisis de las respuestas de larga vida inducidas por inmunoestimulantes y sus efectos sobre una infección viral en Pez cepez (Danio rerio) [J]. Fronteras en inmunología, 2018, 9 :1575.
[15] KRISHNAN R, JANG Y, OHM.Beta g Lucan inducida inmune a protege against nervous necrosis virus Infección infección infección infección infección infección infección infección infección infección infección infección infección infección in Sevenband (en inglés). Mero [J]. pescado & Inmunología del marisco, 2022, 121 :163-171.
[16] PERVEEN S, YANG L, ZHOUS, et al. − 1,3-g Lucan from Euglena gracilis as an Inmunoestimulante media el efecto arasiantip contra Mesanophrys sp. en hemoytes en cangrejo marino nadador (Portunus trituberculatus) [J]. Pescado y pescado Inmunología de los moluscos, 2021, 114:28-35.
[17] DAWOOD M A O, ABDO S E, GEWAILY M S,et al. The influencia of Dieta dieta − -g Lucan on … … … … … … … … … … … … … … … … Transcripción tomica, inflammatory and Trastornos psiquiátricos caused B) deltametrin Toxicidad toxicidad in Nilo tilap ia (Oreochromisniloticus) [J]. Pescado y pescado Inmunología del marisco, 2020, 98:301-311.
[18] CAO CAO H, YU R, ZHANG Y, et al. efectos of Suplementación dietética con → -g de Lucan y Bacillus subtilis en la línea g, filet Calidad, Inmune inmune inmune Capacidad, Y el estado antioxidante of Pengze crucian carp (Carassius
auratus var. Pengze) [J]. Acuicultura, 2019, 508:106-112.
[19] LI H, XU C, ZHOU L, et al. beneficioso effects Of Dieta dietaβ-g Lucan on La Unión europeaand Health status of Pacific White (en inglés) shrimp Litopenaeus vannamei at Baja salinidad [J]. Fish& Inmunología del marisco, 2019, 91: 315-324.
[20] LIANG Z L, MA Y P, Y G Q, et al. efectos De − -g Lucan on La Unión europea Fabricación a partir de Inmune inmune inmune Y antioxidante índices of Trionyx sinensis [J].Guangdong agricultura Ciencias, 2019, 46(4) : 95-100. (en chino)
[21] AKHTAR M S, TRIPATHI P H, pandea, et al. − -g Lucan Modular la expresión génica inmune no específica, Térmica térmica térmica térmica térmica térmica térmica térmica térmica térmica térmica térmica térmica térmica tolerancia and elicits Resistencia a la enfermedad en los endang erojoTor putitora Fry Aeromonas salmonicida [J]. Pescado y pescado Inmunología del marisco, 2021, 119 :154-162.
[22] CHENJ, DAI B T, WANG H M, et al. efectos De añadir − -g Lucan to feed on the Fabricación en la cual todas las materias utilizadas se clasifican en una partida diferente a la del Índices inmun, transcriptoma y flora intestinal de Epinephelus fuscoguttatus i Epinephelus lanceolatus ♂ [J]. Revista de agricultura del sur, 2022, 53(5) :1434-1447.
[23] CHEN J, LEI Y, DONG Z, et al. Daños toxicológicos sobre cobre Exposición exposición exposición exposición exposición exposición to IgM+ B Células células De Nilo tilap ia (Oreochromis niloticus) and Mitigación de mitigación of en effects B) − -g Lucan Administración [J]. Toxicology inVitro, 2022, 81 :105334.
[24] WANG L, ZHANG X X, WANG D M, et al. Estimulación inmunefecto del-1,3-g de Lucan sobre las células sanguíneas de cangrejos de cangrejo rojo [J]. Diario de la agricultura del sur, 2019, 50(4) :883-890. (en chino)
[25] KOCH JF A, DE OLIVEIRA C A F, ZANUZZO F S. Dieta dieta − -g Lucan (MacroGard® ) improves Inmune Inn respuestas and enfermedad resistance in Nile tilapia Sin importar of the administración P eriod[J]. Fish& Inmunología del marisco, 2021, 112 :56-63.
[26] SHITULENI A S, FANG G, SONIA A N, Et al.Effects of yeast polipolisacáridos on Índices bioquímicos, antioxidantes Estatus, Histo p atholo gical (en inglés) Lesiones y expresiones g enéticas relacionadas con el metabolismo de Lip ID en ratones fed with high Grasa grasa Dieta [J]. Carbohidratos bioactivos y fibra diet, 2016, 8(2) :51-57.
[27] BELL S, GOLDMAN V M, BISTRIAN B R, et al. Efecto de la Beta-g Lucan from avena and yeast on Suero labial [J]. Crítica crítica comentarios in La comida ciencia And Nutrition, 1999, 39(2) :189-202.
[28] LOPES L M F, MELLO M M M D, URBINATI E C. − -g Lucan reduces cortisol P lasma Niveles, Mejora Inn Sistema inmunitario Después de A. Inoculación hidrophila, and has Lipol itico effects on the Pacú (Piaractus mesopotamicus) [J]. Aquaculture, 2022, 546 :737411.
[29] ZHAO H X, CAO J M, WANG A, et al. Efecto efecto A largo plazo administración of Dieta dieta − 1,3-g de Lucan En la fila del sol, La presente decisión and Inmune inmune inmune respuestas En Litopenaeus vannamei ( Boone, 1931 ) [ J ]. Aquaculture International, 2012, 20(1) :145-158.
[30] YANG G, QIU H, YU R, et al. Suplementos dietéticos of − -g Lucan, inulina and La emodina modula la respuesta antioxidante y suprime la inflamación intestinal grass Carpa (ctenofaringodon Idellus) [J]. Animal ScienceandTechnology, 2021, 272:114789 (en inglés).
[31] WU WUC Y, CAO J M, HUANGY H, et al. Efectos de la suplementación con − - g de Lucan sobre el rendimiento de la fila g, la composición corporal, los índices bioquímicos séricos y la resistencia al amoníaco nitro gen El estrés o el estrés of La lub (Lateolabrax japonicus) [J]. Chino chino revista of Animal Nutrition, 2013, 25(12) :3033-3040.
[32] SOUZA F P D, LIMA E C S D, PANDOLFI V C F,et al. Efecto efecto of − -g Lucan in water on G rowth p erformance, Blood status and intestinal Microbiota microbiotain tilap ia enhypoxia[J]. Informes sobre la acuicultura, 2020, 17:100369.
[33] CAO J M, ZHAO H X, HUANG Y H, et al its aplicación in aquatic Animales [J]. Feed Industry, 2013, 34(18) :1-6.
[34] LIU: Y, HUANG G. The derivatization and antioxidant activities of yeast Mannan [J].InternationalJournalofBiologicalMacromolecules, 2018, 107(PtA) :755-761.
[35] WANG WL, ZHOU J S, CHEN M Q, et al. Efectos del − -g Lucan on Crecimiento, intestinal Recurso de casación Actividad enzim and liver antioxidant capacity of J uvenile Asian (en inglés) Salmón [J]. suroeste China Journal FEOGA Ciencias, 2021, 34(3) : 673-678.
[36] WANG Y H, ZHANG J S, ZENG L.efecto protector Y mecanismo de − -g Lucan sobre J uvenile cropfish amarillo grande en hipóxia Estrés [J]. Journal pesca of China, 2018, 42(6) : 828-837. (en chino)
[37] ZHU M, WU S. The La Unión europea P er C o No específica Inmunidad inmunidad of Loach Paramisgurnus dabryanus as afectada B) Dieta dieta − -1,3-g Lucan [J]. Fish& Inmunología del marisco, 2018, 83 :368-372.
[38] BAGNI M, ROMANO N, FINOIA M G, et al. Corto y A largo plazo effects of a Dieta dieta yeast − -g Lucan
(macrogard) and algínicos acid (ergosan) preparación immune response in sea bass (Dicentrarchus labrax) [J]. Pescado y pescado Inmunología de moluscos, 2005, 18(4) :311-325.
[39] DAWOOD M A O, KOSHIO S, ISHIKAWA M, Et al. fisifisio Respuesta, sangre Química química P rofile y mucomuco secretion of red sea besbes (Pagrus major) fed dietas supplemented with Lactobacillus rhamnosus under low salinidad Estrés [J]. pescadoPhysiology and Biochemistry, 2017, 43(1) :179-192.
[40] CHEN J W, GUO D Y, ZHAO B, et al. efectos Of Dietary β-g Lucan and inactivated lactic acid bacteria on g rowp erforman, intestinal Grasa grasa acid Composición e inmune P er C o of J uvenile Loach [J]. Acta ActaHydrobiologica Sinica, 2019, 43(1) : 52-59.
[41] ZHAO H X, CHEN B, MO W Y, et al. efectos Alimentos dietéticos − 1,3-g de Lucan on La Unión europea Fabricación a partir de Metabolismo del suero, immune-related gene expression Y resistencia to nitrite Nitro gen stress in Litopenaeus vannamei [J]. Acta hidrobiológica Sinica, 2021, 45(3) :593-600. (en chino)
[42] DIVYA M, GOPI N, ISWARYA A, et al. − -g Lucan extraído de microorganismos eucarióticos Saccharomyces Cerevisiae: Dietary Suplemento y mejorado amonamonamonamonamonamonamonamonamonamonamon stress tolerancia on Oreochromis mossambicus[J]. microbiano Pathogenesis , 2020, 139 :103917.
[43] WANG Y, JIL Q, SUN G X, et al. Efectos dietéticos de − -g de Lucan on P Artie La Unión europea índices and Índices genéticos de sangre De arco iris trucha [J]. Avances en ciencias de la pesca, 2018, 39(3) :65-71. (en chino)
[44] J W, QI Z L. efectos of − -g Lucan on G rowth p erformance and serum Biographical indices (en inglés) De pez de gato amarillo Pelteobagrus Fulvidraco) [J]. Hebei Fisheries, 2017, 3 :1-4.
[45] janjani M H, GHAEDI G, SHARIFINIA M. efectos of dietas containing − -g Lucan on Supervivencia, La Unión europea Fabricación a partir de Haematolo gical, Inmunidad inmunidad Y bioquímica parameters of rainbow Trucha (Oncorhynchus mykiss) Fing erlings[J]. Aquaculture Research, 2022, 53(5) :1842-1850.
[46] JI L, FU S, JI R, et al. − -g Lucan Trinitrobenbeno mitigado sulfonic induindu Enteritis. in El arco iris trout Oncorhynchus mykiss ) [J]. Aquaculture, 2019, 513 :734393.
[47] LI Y J, WANG W M, HUANG Y H, et al. Efectos de − -g Lucan Suplementos suplementos on La Unión europea Fabricación a partir de Índices bioquímicos séricos y resistencia a Aeromonas hydro p hila infection of J uvenile amarillo Bagres (Pelteobagrus fulvidraco) [J]. Chino diario de Animal Nutrición, 2015, 27(12) : 3754-3762.
[48] PILARSKI F, FERREIRA D O C, DARPOSSOLO D S F,et al. diferentes beta-glucans improve the Rendimiento de crecimiento y resistencia bacteriana en Niletilapia[J]. Fish& Inmunología del marisco, 2017, 70:25-29.
[49] BOOMAN (en inglés). M, FORSTER Yo, veve, J C, et al. soja induinduindu enteritis in Atlántico salmon (Salmo Salar) and chinook salmon (Oncorhynchus tshawytscha) pero no en salmón rosado (O.gorbuscha)[J]. Aquaculture, 2018, 483 :238-243.
[50] CHEN Z, LIN S, JIANG Y, et al. efectos of Lucan beta-g en ratones con estreñimiento inducido por lo p eramida [J]. Journalof Medicinal Food, 2019, 22(10) :1009-1021.
[51] El Consejo europeo de Madrid, celebrado en et al. probióticos effect De Streptomyces cepas solo or in combination Con Bacillus y Lactobacillus en j uveniles of the camarcamarcamar Litopenaeus vannamei [J]. Aquaculture International, 2017, 25(2) :927 — 939.
[52] CAO H, WANG A G, LIU G D. Aditivos compuestos y su aplicación [A]. The 8th China International La comida(en inglés) Aditivos aditivos and ingredientes Exposición exposición and El 11 nacional Food Aditivos aditivos producción and
aplicación Technology Exposición [C]. 2004.
[53] MIAO S, HAN B, ZHAO C, et al. efectos of Pediococcusacidilactici GY2single o combinado con Saccharomyces cerevisiae O/y − -g Lucan on La fila g, inninninn Inmunidad inmunidad response and Resistencia a la enfermedad de Macrobrachiumrosenbergii[J]. Pescado y pescado Inmunología del marisco, 2020, 98:68-76.
[54] DIMITROGLOU A, MERRIFIELD D L, SPRING P, et al. efectos of mannan oligosacárido Administración de suplementos on La Unión europea Fabricación a partir de Utilización del pienso, intestinal Histolo Gy and El intestino microbiota De dorada dorada (Sparus aurata)[J]. Acuicultura, 2010, 300(1-4) :182-188.
[55] CHIU C, GUU Y, LIU C, et al. Inmune inmune inmune Respuestas y gene expression in blanco Camarón, Lito Penaeus vannamei, inducido b y Lactobacillus plantarum[J]. pescado & mariscos Inmunología, 2007, 23(2) :364-377.
[56] El guión G, RAMAN R P, PANI PRASAD K, et al.evaluación de la aplicabilidad paraprobiótica de Lactobacillus plantarum in Roving y tus panes the Respuesta inmune respuesta inmune and enfermedad Protección protección in gigante Camarón de agua dulce, acrobrachiumrosenbergii (de Man, 1879) [J].Fish & mariscos Inmunología, 2015, 43(1) :167-174.
[57] MAGOUZ F I, SALEM M F I, EMARA A E I, et al. A mezcla of − -g Lucan and Mannanoligosacárido mejorado the g rowth Tasa, Recurso de casación Actividad enzim, intestinal Morfometría, and immunity común carp (Cyprinus carpio) [J]. anales Of Animal Science, 2021, 21(3) :1027-1041.
[58] ANJUGAM M, ISWARYA A, SIBIYA A, Et al.interacción molecular análisis anal de ≥ 1,3 G Lucan binding p rotein with Bacilluslicheniformis and evaluation of ITS (en inglés) immunostimulant propiedad in Oreochromis
Mossambicus [J]. pescado & mariscos Inmunología, 2022, 121 :183-196.
[59] EL-NOBI G, HASSANIN M, KHALIL A A, et al.efectos sinbióticos de Saccharomycescerevisiae, mannan oligosacáridos, and − -g Lucan on inninninn Inmunidad … … antioxidant Estatus, and disease resistance of Nile tilap ia, Oreochromis niloticus [J]. Antibióticos, 2021, 10(5) :567.
[60] YAMAMOTO F Y, YIN F, ROSSI W J, et al. Beta- 1,3 g Lucan derivado de euglena g racilis and Algamune inninninn immune respuestas of red Tambor (Sciaenops ocellatus L.) [J]. Fish & Inmunología del marisco, 2018, 77:273-279.
[61] LI F D, YE J D, WANG K, et al. Efectos de la alimentación continua a largo plazo de − -g Lucan sobre la fila g p erformany non-specific immune función of Cyprinus Carpio [J]. Chino chino Journal of Animal Nutrición, 2009, 21(4) :499-505.
-
anterior
¿Es el Beta Glucan bueno para ti?
-
siguiente
¿Cuál es el uso del polvo Beta Glucan en la alimentación Animal?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés



