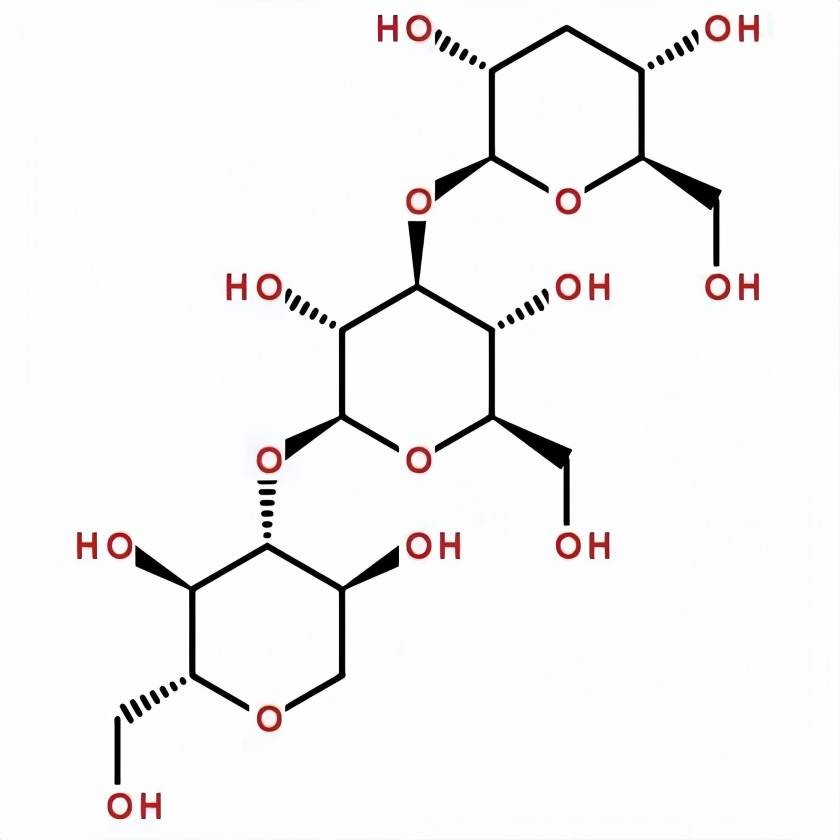
¿Qué es − 1 3 Glucan?
Beta-1,3-glucanEs ununclase de polisacáridos de alto contenido molecular que se encuentran ampliamente en la naturaleza, con una cadena principal de unidades de glucosa Unidas por enlaces beta1,3-glicosídicos. Algunos naturales -1,3-glucanos también contienen cadenas laterales Unidas por enlaces -1,6-glicosídicos en diferentes proporciones y tamaños. Por ejemplo, las cadenas laterales de fucoidan de algas pardas contienen cerca de 30% ± -1,6 estructuras ramienlazadas y por lo tanto son hidrosolu[1]. Los − 1,3-glucanos naturales están ampliamente distribuidos en hongos, bacterias y plantas. Los − 1,3-glucanos comunes incluyen fucoidan, carragenano, glucan de levadura, polisacárido de cocos de poria, polisacárido de hongo shiitake, callosa, etc. Debido a la forma en que los enlaces -1,3-glicosídicos están conectados y las interacciones de enlace de hidrógeno entre las moléculas, la cadena larga -1,3-glucanos usualmente exhidiferentes estructuras tercihelien su estado natural [2]. Estas especiales estructuras terciarias dotan al − -1,3-glucanos con diversas funciones biológicas, incluyendo la regulación de la inmunidad [3], la promoción de la proliferación de probióticos intestinales [4], la regulación del balance de azúcar en la sangre y la reducción del colesterol [5]. La actividad biológica del -1,3-glucano y su especial estructura terciaria han atraído una amplia atención en los campos de la alimentación, los productos químicos diarios y la medicina.
β-1,3-glucanase is a class of enzymes that can hydrolyze glucan linked by β-1,3-glycosidic bonds, and plays an important role enthe biodegradation, reconstruction, and development and application of β-1,3-glucan. In nature, β-1,3-glucanase is widely distributed in archaea, bacteria, fungi, higher plants and animals. β-1,3-glucanase has a wide range of applications in the food and pharmaceutical industries, such as the preparation of low molecular weight β-1,3-glucan oligosaccharides, reducing the viscosity of beer fermentation broth, and inhibiting post-harvest pathogenic fungi in fruits and vegetables.
Aunque los investigadores han hecho mucha investigación sobre la expresión y purificación, la estructura molecular, las propiedades enzim, y el mecanismo catalítico de la -1,3-glucanasa, la estructura compleja de diferentes tipos de -1,3-glucano limita su amplia aplicación. La participación sinérgica de − -1,3-glucanasas de diferentes familias y con diferentes modos de acción es necesaria para la degradación eficiente del complejo − -1,3-glucanos. Por lo tanto, una profunda comprensión de la estructura, función y modo catalítico de los diferentes tipos de -1,3-glucanasas es de gran importancia para la aplicación y posterior modificación molecular de las -1,3-glucanasas. Este artículo resume el progreso de la investigación en la estructura, función y campos de aplicación de las glucanasas típicas ≥ 1,3, con el objetivo de proporcionar una referencia para la investigación posterior sobre sus mecanismos catalíticos y su aplicación en los campos de la alimentación, la medicina y otros campos.
1 clasificación de − 1,3 glucan y sus mecanismos catalíticos
Las glucanasas − 1,3 se pueden dividir en endo-tipo y exo-tipo de acuerdo con su modo catalítico. Endo- − -1,3-glucanasa (EC 3.2.1.39), también conocida como enzima polisacáride de kombu, es una enzima que hidrolizespecíficamente los enlaces -1,3-glicosídicos en las cadenas de azúcar -1,3-glucan. Juega un papel biológico clave en la descomposición y reconstrucción de -1,3-glucano en la naturaleza y su familia. Las endo-1,3 - − -glucanasas hidrolizan − -1,3-glucano desde el interior de la cadena de azúcar, produciendo una serie de oligosacáridos con diferentes grados de polimeri. Exo- − -1,3-glucanasa (EC 3.2.1.58) hidroliza − -1,3-glucan sustruno tras otro desde el extremo no reducde la cadena de azúcar. Los productos hidrolizados son generalmente glucosa o oligosacáridos individuales, y juegan un papel de apoyo en la degradación de -1,3-glucano. Basándose en su relación evolutiva, las -1,3-glucanasas descubiertas pueden ser clasificadas en 12 familias de glucosidos hidrolasa (GH) según la base de datos de CAZy (http:// www.cazy.org/). Entre ellas, las endo- − -1,3-glucanasas se pueden clasificar en 9 familias GH (figura 1): GH16, GH17, GH55, GH64, GH81, GH128, GH152, GH157 y GH158; Las exo- − -1,3-glucanasas que han sido descubiertas se pueden clasificar en 6 familias GH: GH3, GH5, GH17, GH55, GH128 y GH132.
Las -1,3-glucanasas tienen dos mecanismos de hidróli, a saber, el mecanismo conservador y el mecanismo de inversión [6]. El proceso catalítico del mecanismo de hidróliretense divide en dos pasos. En primer lugar, el residuo de ácido glutámico en el centro activo actúa como un ácido general (donante de electrones) para proporcionar un protón al oxígeno del enlace glicosídico para eliminar el grupo saliente, romper el enlace -1,3-glicosídico, y formar un intermediario enzima-glicósido.
Posteriormente, el residuo de ácido glutámico en el centro activo actúa como una amplia base, ayudando a la molécula de agua en el ataque de la posición de carbono heteroátomo del intermediario enzimglucósido. Finalmente, el enlace -1,3-glicosídico del sustres hidrolizado, formando el producto hidrolítico finAl.El mecanismo de retención se llama así porque la conformación del sustres retenpor las dos inversiones en el carbono heteroátomo. El mecanismo de inversión de la -1,3-glucanasa involucra dos residuos catalíticos conservados, un ácido general y una base general. Durante la reacción, el ácido general primero dona un protón al carbono anomérico del sustr, mientras que la base general elimina un protde una molécula de agua, aumentando su nucleofilia y promoviendo su ataque sobre el centro del grupo anomérico, rompiasí el enlace glicosídico y generando el producto hidrolítico (figura 2).
2. Fuentes y preparación de 1,3-glucano
β-1,3-glucan is mainly derived from fungi, bacteria, plants, insects and molluscs. Table 1 summarizes the typical β-1,3-glucanases from different sources that have been reported to have application potential. The main bacteria that have been reported to produce β-1,3-glucanase are Pyrococcus furiosus [7], Paenibacillus polymyxa [8], Bacillus lehensis G1 [9], Streptomyces sp. [10], etc. Fungi and plants are also important sources of β-1,3-glucanase, including Aspergillus fumigatus [11], Trichoderma asperellum [12], Phanerochaete chrysosporium [13], barley [14], grapes [15], etc.
Natural sources of β-1,3-glucans are abundant, stable in nature, and exhibit specific catalytic activity, showing unique application potential. For example, β-1,3-glucanase produced by Paenibacillus terrae [16] can effectively inhibit the growth of plant pathogenic fungi and play an important role in plant protection. β-1,3-glucanase derived from Arca inflata [17] has β-1,3-glucanase has high activity and exhibits an immune-enhancing effect on tumor necrosis factor.
El -1,3-glucano de Trichoderma harzianum [18] es una enzima candidata ideal para la producción de -1,3-oligosacáridos y se puede utilizar para la preparación industrial de oligosacáridos. Además de descubrir las -1,3-glucanasas con excelentes propiedades de fuentes naturales, la tecnología de expresión recombinhetertambién se puede utilizar para descubrir y preparar las -1,3-glucanasas, ampliando así sus fuentes, aumentando los niveles de expresión, y ampliando el alcance de las aplicaciones de la -1,3-glucanasa.

En la actualidad, los huéspedes para la expresión recombinante de -1,3-glucan incluyen principalmente Escherichia coli, Pichia pastoris, Bacillus subtilis, etc. El sistema de expresión de E. coli es tecnológicamente más maduro y relativamente simple de operar que el sistema de expresión de levadura, y es ampliamente utilizado en el descubrimiento y preparación de nove-1,3-glucano. Por ejemplo, − -1,3-glucan de fuentes como la levadura antagónica Pichia guilliermondii [19], el macrogenoma de los microorganismos del rumen alce [20], y Pseudomonas aeruginosa [21] se obtienen por preparación recombinante en E. coli. Todas las enzimas se obtienen mediante la preparación recombinante de Escherichia coli. El − -1,3-glucan MoGluB derivado de Magnaporthe oryzae puede ser expresado eficientemente por el sistema de E. coli y exhibe actividad antifún[22].
Aunque la expresión procariótica en E. coli tiene las ventajas de un rápido crecimiento y bajo costo, algunos genes eucarióticos no pueden ser expresados efectivamente porque el sistema de expresión procariótica no puede reconocer elementos de transcripción y traducción eucarióticos y no tiene la función de modificación post-traduccional. Por lo tanto, en los últimos años, los investigadores también han utilizado comúnmente sistemas de expresión eucariótica para expresar -1,3-glucanasa, como los sistemas de expresión de Pichia pastoris y Bacillus subtilis [23]. Durante el proceso de expresión inducible de Pichia pastoris, la cantidad de proteína secretada por sí misma es relativamente pequeña, por lo que la cantidad de expresión de la proteína objetivo es relativamente alta.
Sin embargo, debido a que algunos − 1,3-glucan tienen un efecto hidrolítico en la pared celular de la levadura, su aplicabilidad necesita ser verificada experimentalmente. La tecnología de expresión heteróloga recombinante se ha convertido en un método importante para la investigación y preparación de aplicaciones de -1,3-glucano. Mientras tanto, la combinación de biología estructural, biología molecular, evolución dirigida y otros métodos de investigación para modificar molecularmente el -1,3-glucano obtenido por recombinación heteróloga puede mejorar aún más el rendimiento catalítico y el valor de aplicación de la enzima. Feng Jianwei etal. [24] descubrieron un termófilo − 1,3-glucano a partir de compost. Mediante mutagénesis in situ, los 160 aminoácidos se cambiaron de lisina a ácido glutámico, lo que aumentó su actividad enzimen un 1 7%. Muhammed etal. [25] usaron los programas modeller e I-TASSER para realizar el modelado de homología de un − 1,3-glucano de la levadura Wickerhamomyces normus NCYC 434. Posteriormente, la estabilidad térmica del modelo fue mejorada usando SPDBViewer y AUTO-MUTE. Se encontró que el mutante E186R tenía la mejor estabilidad térmica, y su temperatura de fusión se incrementó en 9,58 K.
3 estructura y mecanismo catalítico de endo-1,3-glucan
3.1 Endo- − -1,3-glucan
El Endo- − -1,3-glucano, también conocido como la enzima polisacáride kombu, puede hidrolizar y cortar enlaces − -1,3-glicosídicos al azar desde el interior de las cadenas de − -1,3-glucan, produciendo oligosacáridos de diferentes longitudes. Se ha informado que las endo- − 1,3-glucanasas se distribuyen principalmente en las cuatro familias GH GH16, GH17, GH64 y GH81. Hasta ahora, la estructura y el mecanismo catalítico de las endo- − -1,3-glucanasas de seis familias de GH,GH16, GH17, GH64, GH81, GH128 y GH158, se han resuelto. Ha habido pocos informes sobre la estructura de las endo- − 1,3-glucanasas de GH55, GH152 y GH157, y sus mecanismos catalíticos detallados aún no han sido aclarados.
3.1.1 GH16 familia endo- − -1,3-glucan
All GH16 family β-1,3-glucanHasta el momento se han reportado endotipos, ampliamente distribuidos en bacterias, hongos y arqueas, con un predominio de fuentes bacterianas. La estructura tercide la familia GH16 − 1,3-glucanasas es rica en − -pliegues. Estas cadenas son dobladas y dobladas en dos estructuras lamelares paralelas cara a cara, formando un surco catalítico largo y estrecho para la Unión de sustrde cadena larga. Fibriansah etal. [26] informaron en 2007 la estructura de una familia de GH16 de acción endo-1,3-glucanasa (BglF) derivada de Nocardiopsis sp. y la definicomo una estructura clásica de gelatina plegen en forma de sándwich. Las GH16 de la familia − 1,3-glucanasas siguen un mecanismo de hidróliconservado típico, y se forman intermediarios enzimininestables durante la reacción [27].
La especificidad de sustrde la familia GH16 − 1,3-glucan está directamente relacionada con la estructura del surco catalítico, y tienen diferentes habilidades hidrolíticas para diferentes sustratos. Por ejemplo, la − -1,3-glucanasa ZgLamA de la bacteria marina Zobellia galactanivorans tiene una eficiencia catalítica casi 22 veces mayor para el sustrde polisacárido de algas (laminarin) que para el glucan de enlace mixto (ML G) (− -1,3-1,4-glucan) por casi 22 veces. Esto se debe a que el centro catalítico de ZgLamA presenta una conformación cóncava, que es propicio para la Unión de la hélice − 1,3-glucan en lugar de la lineal − 1,3-1,4-glucan (figura 3B).

3.1.2 GH17 familia endo-tipo − 1,3-glucan
The GH17 family β-1,3-glucan includes both endo-type and exo-type, and most of them are endo-type, mainly derived from plants. At present, the GH17 family β-1,3-glucanase with a solved structure is all endo-type. GH17 family proteins have a typical (β/α) 8 TIM(triose-phosphate isomerase) barrel structure (Figure 4), formed by 8 α-helices and 8 β-folds, which form a long and narrow catalytic groove on the surface of the entire enzyme that can accommodate long-chain substrates and run through. The β-chains in the core region of the barrel structure are highly conserved, and the main differences occur in the loop structures and helical structures on the periphery of the protein. GH17 family endo-β-1,3-glucanases, similar to GH16 family, follow a typical conserved hydrolysis reaction mechanism, and an unstable enzyme-glycoside intermediate is formed during the reaction.
Wojtkowiak etal. [35] obtuvieron la estructura cristalina del cocristal de la papa endo- − -1,3-glucano (GLUB20-2) mutante E259A y el fucoidan (figura 4B), que es la primera estructura cristalina compleja de una glucosidasa de la familia GH17 y una molécula oligosacárida obtenida por los investigadores. A pesar de que su sitio activo estaba mutado, GLUB20-2E259A todavía tenía actividad residual. El análisis de espectrometría de masas reveló que el mutante escindila hexosa de fucoidan de dos maneras, produciendo dos moléculas de fose trisacáridos o una molécula de fose tetrasacárido y una molécula de fose disacárido. El surcatalítico de GLUB20-2 forma una geometría similar a un cañón con extremos abiertos y un centro curvo, lo que excluye la posibilidad de sustrlineales como la Unión de − 1,4-glucan al sitio de Unión. Esto indica que la geometría de la hendidura del sitio activo determina la especificidad del sustrde de la enzima.
3.1.3 GH64 familia endo- − -1,3-glucan
Actualmente, todas las proteínas de la familia GH64 reportson endo-tipo − 1,3-glucanasas, principalmente derivadas de bacterias. Las endo-tipo − 1,3-glucanasas de la familia GH64 son también conocidas como fucopentaose-tipo − 1,3-glucanasas. Se caracterizan por catalizar la hidrólisis de -1,3-glucano para producir principalmente fucopentaosa como producto de hidróli. La familia GH64 de endo- − -1,3-glucanasas sigue un mecanismo catalítico típico de la invertasa, con residuos de ácido aspaspcerca del centro catalítico actuando como bases de base amplia y residuos de ácido glutámico actuando como ácidos de base amplia para participar en la reacción de hidróli. Wu Et al.[39] obtuvieron una familia GH64 -1,3-glucanasa (lfase) de Streptomyces matensis. La lfase consiste en dos dominios: el C-terminal es un dominio de estructura compuesto de − -hélice y − -pliegue, y el N-terminal es un dominio compuesto de dos conjuntos de − -pliegues paralelos inversos. Los dos dominios forman un surcatalítico en forma de u (figura 5).
Qin Zhen et al. [40] reportaron el modo de Unión de una familia de GH64 − -1,3-glucanasa (PbBgl64A) de Paenibacillus barengoltzii con una heptaosa de kombu, en la que las dos cadenas oligosacáridos forman una héy se unen a la ranura catalítica de PbBgl64A al mismo tiempo (Fig. 5B,C). Esto sugiere que el − -1,3-glucan puede estar directamente unido en la forma de triple héen el surco catalítico de la familia endo- − -1,3-glucanasa del GH64. El modo de Unión de la familia GH64 − -1,3-glucanasa a latriple-helix β-1,3-glucan substrate is related to the plant disease process. The binding mode of the antifungal sweet protein to the β-1,3-glucan helical sugar chain is similar, indicating a novel binding mode of glycoside hydrolases directly binding to the substrate of the polysaccharide four-fold structure [41-42].
3.1.4 GH81 familia endo- − -1,3-glucan
Las proteínas de la familia GH81 están ampliamente distribuidas en bacterias, hongos, plantas y arque, y todas ellas son endo- − -1,3-glucan. Hasta ahora, las estructuras cristalcristalde tres GH81 familia − 1,3-glucan se han resuelto: BhGH81 de Bacillus halodurans, CtLam81A de Clostridium thermocellum [43] y RmL am81A[44]. La GH81 endo-type − 1,3-glucanasa consta de tres dominios estructurales. El dominio N-terminal tiene una estructura sándwich − -doblada y contiene dos conjuntos de hojas − -dobladas antiparalelas. El dominio C-terminal tiene una estructura típica (− / −) de 6 cañones. El pequeño dominio estructural entre los dominios N-terminal y C-terminal contiene dos β -pliegues antiparalelos y dos α -hélices. Los tres dominios estructurales juntos forman un largo y estrecho surco catalítico vertical (Fig. 6).
Ma Junwen et al. [45] reportaron una familia GH81 − -1,3-glucan (RmLam81A) de Rhizomucor miehei y reveló su reconocimiento de sustry mecanismo catalítico. Los estudios han demostrado que RmLam81A puede unirse a la triple hé-1,3-glucan y seguir un mecanismo de hidrólisis retrótípico, que generalmente se logra en un solo paso. El residuo de ácido aspártico conservado en el centro catalítico actúa como un ácido general para protonar el átomo de oxígeno en el enlace glicosídico, mientras que el residuo de ácido glutámico actúa como una base general para desprotonarlo, rompiasí el enlace glicosídico y completando el proceso de hidróli. Pluvinage et al. [46] notificaron una familia GH81 − -1,3-glucanasa (BhGH81) derivada de la bacteria halotolerante Bacillus halodurans. Glu542 mutante a Gln o Asp466 a Asn inactiva completamente BhGH8, lo que indica que Glu542 y Asp466 son sus residuos catalíticos clave. Además, la estructura compleja de la enzima con la cadena polisacárida indica que puede unirse al menos a dos cadenas separadas − 1,3-glucano (figura 6B), lo que significa que la enzima puede ser capaz de unirse directamente a la triple hé− 1,3-glucano (figura 6C).
3.2 Exo- − -1,3-glucan
La Exo- − -1,3-glucanasa hidrolisa − -1,3-glucan al cortar los enlaces − -1,3-glicosídicos al final de las cadenas, secuencialmente, para producir glucosa o oligosacáridos individuales. Se ha encontrado que las exo-tipo − 1,3-glucanasas se clasifican en seis familias GH: GH3, GH5, GH17, GH55, GH128 y GH132, la mayoría de los cuales pertenecen a las familias GH55 y GH5. Las estructuras cristalde la exo-acción − 1,3-glucanasas de las familias GH5, GH55 y GH128 se han resuelto, mientras que las de GH3, GH17 y GH132 rara vez se han resuelto.
La familia GH55 de las -1,3-glucanasas se deriva principalmente de bacterias y hongos, y la mayoría de ellos son exo-actantes. Las proteínas de la familia GH55 tienen dos dominios paralelos derecho − -helique que forman una estructura similar a las costillas del pecho. Los extremos N-terminal y C-terminal tienen cada uno 7 y 10 bobcompuestas de dominios derecho − -heli, respectivamente, conectados por un segmento de residuos de aminoácidos. El residuo incluye dos pliegues paralelos paralelos, y el sitio catalítico se encuentra entre los dos dominios (figura 7A). Bianchetti et al. [47] encontraron que la estructura del complejo de sustrdel exo-tipo → -1,3-glucanasa (sacteLam55A) derivado de Streptomyces (Setreptomyces sp.) mostró que las GH55 exo-tipo familia → -1,3-glucanasas tienen un surco catalítico de tipo de bolsa con seis sitios de Unión glicosídica, que puede cortar sucesivamente monosacáride glucosa desde el extremo no reducde la cadena de azúcar (figura 7 B). El ácido general primero dona un protón al sustr.#39;s carbono heteroátomo, mientras que la base general elimina un protón de la molécula de agua, aumentando su nucleofilicidad y promoviendo su ataque sobre el centro del heteroátomo, rompiasí el enlace glicosídico y produciendo el producto hidrolítico. Papageorgiou et al. [48] descubrieron una -1,3-glucanasa (CtLam55) derivada del Chaetomium thermophilum, y determinaron que el Glu654 es un residuo catalítico clave a través de la comparación estructural y la mutagenesis dirigida al sitio.
3,3 GH128 familia − 1,3-glucan
En los últimos años, se han descubierto algunas nuevas -1,3-glucanasas clasificadas como GH128 en la base de datos de CAZy. Las GH128 familia − -1,3-glucanasas pertenecen a la superfamilia GH-A y tienen una región de Unión a los carbohidratos y una (- / -) 8-barrel estructura [49]. La estructura de barril es la más corta entre todas las conocidas GH128 familia, con un promedio de sólo 240 residuos de aminoácidos [50]. Esta familia incluye tanto las endo- como las exo--activas − 1,3-glucanasas.
Santos et al. [50] usaron el agrupamiento de redes de similitud de secuencias para dividir la familia GH128 en siete subgrupos y analizaron el modo de Unión al sustrato de cada subgrupo. Encontraron que el modo de Unión al sustrde la familia GH128 − 1,3-glucanasas está estrechamente relacionado con las interacciones hidrofóbicas, y que entre los siete subgrupos, las cadenas de azúcar se unen a la enzima de dos maneras diferentes: "doblada" y "plana" [50].. Además, la GH128 de la familia -1,3-glucanasa en la tercera subfamilia también puede unirse directamente a la triple hé-1,3-glucan cadena.
3.4 Other Family − -1,3-glucan
Además de las típicas − -1,3-glucanasas de las familias mencionadas anteriormente, un pequeño número de exo-activas − -1,3-glucanasas con una estructura típica de 8 TIM (− / −) también se han encontrado en las familias GH3 y GH5, y todas ellas siguen un mecanismo catalítico retenido. La familia GH132 − -1,3-glucanasa es conocida como una proteína solar y se ha encontrado en hongos filamentosos y levadura [51]. Ha habido pocos informes sobre las proteínas de la familia GH132, y sus estructuras proteicas y mecanismos catalíticos aún no están claros. GH158 familia − -1,3-glucanasa pertenece a la superfamilia GH-A. Hasta el momento, solo se ha reportado un análisis estructural de la familia GH158 − 1,3-glucanasa. Dejean et al. [52] obtuvieron una familia GH158 − -1,3-glucanasa (BuGH158) de Bacteroides uniformis, que consiste en un dominio N-terminal (− / −) 8 TIM barrel y un dominio C-terminal de inmunoglobulina (Ig). Además, la enzima tiene una alta actividad hidrolítica hacia los polisacáridos disponibles y polisacáride kelp.
4 aplicaciones de 1,3-glucan
4.1 − -1,3-glucan en aplicaciones antifúngicas
The decay and deterioration of fruits and vegetables during postharvest transportation, storage and marketing is an important factor affecting the quality, shelf life and safety of human consumption. Decay caused by plant pathogenic fungi is the main cause of postharvest losses of fruits and vegetables. Fungi are eukaryotic organisms, and the cell wall is essential for the survival of fungal cells. Degradation of the cell wall can cause the fungal cells to lose their osmotic pressure balance, so destroying the integrity of the cell wall has become a potential antifungal measure. β-1,3-glucan is an important antibacterial protein secreted by biocontrol microorganisms, and plants themselves also induce the production of β-1,3-glucanase during the process of resisting fungal infection [53].
La − -1,3-glucanasa puede degradlas cadenas de azúcar − -1,3-glucan en la pared celular, causando que el micde de hongos patógenos se rompo o deforme, resultando en una fuga del protoplasma de los hongos patógenos e inhibide la germinde las esporas. Además, este proceso también puede liberar inductores de fragmentos de pared celular fún, inducir inducinmune de la planta, e indirectamente promover la acumulación de fitoalexinas en la planta huésped, aumentando su resistencia a la enfermedad [54]. El método de control biológico basado en -1,3-glucanasa puede prevenir y controlar eficazmente enfermedades fúngicas en plantas. Tiene las ventajas de no resistencia a medicamentos, apuntando solamente el patógeno objetivo sin dañar otros organismos beneficiosos, no residuos de pesticidas, y no toxicidad o contaminación. Por lo tanto, explorar el papel de la -1,3-glucanasa en la conservación poscosecha de frutas y verduras y el desarrollo de nuevos conservantes biológicos verdes basados en la -1,3-glucanasa es una de las tendencias de desarrollo potencial en la tecnología de conservación verde para frutas y verduras.
Lou Shubao et al. [55] determinaron la actividad de la -1,3-glucanasa en hojas de soja y su efecto antibacteriano en hongos. Los resultados mostraron que la actividad de -1,3-glucanasa de la planta alcanzó un pico 48 horas después de la inoculación con Phytophthora sojae. El experimento antibacterise se llevó a cabo utilizando extracto de la enzima glucanasa bruta ≥ 1,3-glucanasa extraído 48 horas después de la inoculación. Se encontró que la solución cruda de la enzima -1,3 -glucanasa tiene un efecto inhibitsignificativo sobre el crecimiento micelial y la germinde esporas de Phytophthora sojae. Chen Xiaoyun et al. [56] mostraron que la -1,3-glucanasa tiene un efecto significativo en la inhibidel crecimiento de bacterias y enfermedades en frutas como manzanas, peras y bananas después de la cosecha, y puede prevenir eficazmente la pospocosecha causada por hongos. Esta característica puede ser utilizada para el almacenamiento y conservación de frutas tropicales. Rajninec et al. [57] encontraron que la proteína bruta − 1,3-glucanasa del binato de Drosera tenía un efecto inhibitsobre el crecimiento de Rhizoctonia solani, Alternaria solani y Fusarium poae.
4,2 − 1,3-glucan preparación funcional oligosacáridos
β-1,3-glucan, also known as fucoidan oligosaccharides, is a food functional factor with good biological activity, and has the activity of regulating the body's inmunidad, resistencia ala infección y regulación del equilibrio de la flora intestinal. Los oligosacáridos de beta1,3-glucan preparados hidrolizando polisacáridisponibles o polisacáride quelpueden ser usados como un nuevo tipo de prebióen el desarrollo funcional de alimentos. Además, algunos beta1,3-oligosacáridos solubles en pequeñas moléculas pueden usarse como activadores inmunpara inducir respuestas inmunen las plantas y así mejorar la resistencia de las plantas a las enfermedades. Además, algunas pequeñas moléculas solusolubles − 1,3-oligosacáripueden ser utilizados como activadores inmunpara inducir respuestas inmunen las plantas, mejorando así la resistencia de la planta a las enfermedades. − -1,3-glucanasa hidroliz− -1,3-glucan para preparar − -1,3-oligosacáridos, que tiene las ventajas de alta especificidad y pocos subproductos. Se considera un método prometedor para la producción de oligosacáridos. Wang Yanxin et al. [22] encontraron que la familia GH55 − -1,3-glucanasa (AcGluA) puede hidrolizar polisacáridos de algas kelp en una serie de oligosacáridos oligosacáridos, y altas dosis de oligosacáridos pueden inducir una respuesta inmune en las plántulas de arroz, lo que confiere resistencia al Bladel del arroz. Esto muestra que los productos hidrolíticos de la -1,3-glucanasa tienen efectos significativos de biocontrol y proporcionan alguna guía para la aplicación de los -1,3-oligosacáridos.
Li Kuikui et al. [58] cloned and purified a novel β-1,3-glucanase (GcGluE) from Cellulosimicrobium cellulans. El análisis de la especificidad del sustry los productos hidrolíticos reveló que la enzima exhila mayor actividad hidrolítica en los polisacáridos renovables, y los principales productos hidrolíticos fueron los disacáridos y los trisacáridos. Además, después del pretratamiento de homogenei, la eficiencia de degradación de cola gcen xylan aumentará en 7,1 veces, lo que tiene cierto potencial de aplicación. Gao Minjie et al. [18] obtuvieron -1,3-glucanasa de Trichoderma harzianum, y la actividad enzimpodría alcanzar hasta 198,57 U/mL después de 118 h de fermentación. Basado en las características de esta enzima, se estableció un método para preparar oligosacáridos multifuncionales por hidrólisis enzimde -1,3-glucan, lo que hace que la enzima -1,3-glucan tenga ciertas perspectivas de aplicación en la producción industrial de oligosacáridos.

4.3 aplicación de -1,3-glucano en la industria cervec.
Además de su importante papel en la producción de oligosacáriy antifún, la -1,3-glucanasa también puede ser utilizada en la industria cervec. En la industria cervecera, la cebada es la principal materia prima para la producción de cerveza. Durante el proceso de producción, algunos microorganismos secretan alto peso molecular − 1,3-glucano en el espacio extracelular, lo que aumenta la viscodel líquido de fermentación, causando dificultades en la filtración. Eventualmente, se pueden formar geles floculentes en la cerveza, reduciendo la producción de cerveza y aumentando los costos de elaboración. Lu Lili et al. [59] encontraron que, si es apropiado, se agrega − -1,3-glucanasa durante el proceso de fermentación, el contenido de glucan de alto peso molecular puede reducirse significativamente, reduciendo así la viscodel caldo ferment, logrando el propósito de la cerveza magra y mejorando el proceso de filtración.
4.4 − -1,3-glucan preparación de protoplastde levadura
The main chemical component of the yeast cell wall is β-glucan. One type is the relatively abundant β-1,3-glucan, which forms the skeleton of the yeast cell wall. The other type is the less abundant β-1,6-glucan, which fills the space. The key to preparing yeast protoplasts is to break down the insoluble β-1,3-glucan in the cell wall, so β-1,3-glucanase is an important preparation for protoplasts [60]. Duan Huike et al. [61] used the β-1,3-glucanase produced by the Trichoderma strain LE02 to enzymolyze and solubilize the beer yeast glucan. Macromolecular water-soluble yeast glucan can also be obtained by β-1,3-glucanase enzymolysis technology and ultrafiltration separation technology.
4,5 − 1,3-glucan elimina las películas biológicas
Los Biofilms son estructuras complejas compuestas por microorganismos y sus secresecreextracel. Las bacterias clave de deterioro en los alimentos como la Salmonella y Pseudomonas aeruginosa producen biofilms, que pueden reducir el efecto bactericida de los desinfectantes y antibióticos de uso común, lo que representa un riesgo para la seguridad alimentaria. − -1,3-glucano es un componente importante de la biopelícula de Candida albicans y juega un papel importante en la matriz extracelular de la biopelícula. En contraste, la − -1,3-glucanasa tiene un cierto efecto en la eliminación de la película biológica y puede controlar las bacterias de deterioro en la industria alimentaria. Nett et al. [62] encontraron que el tratamiento de Candida con concentraciones bajas de -1,3-glucanasa aumentó significativamente el efecto de los medicamentos antifúngicos fluconazol y anfotericina B sobre el hongo. Mitchell et al. [63] también demostraron experimentalmente que la sensibilidad del fármaco antifúnaumentgradualmente con la hidrólisis de -1,3 glucan en la matriz extracelular, lo que indica que la -1,3-glucanasa tiene cierto efecto en la eliminación de películas biológicas.
4.6 efecto sinérgico de − -1,3-glucan y quitinasa
Ambos − -1,3-glucanasa y quitinasa tienen el efecto de degrad− -1,3-gluy quitina, así como peptidoglicano en la pared celular del hongo. Ambas enzimas tienen un amplio espectro de resistencia en la defensa contra las plagas y enfermedades de las plantas, lo que puede reducir el uso de pesticidas químicos y reducir la contaminación ambiental. Mauch et al. [64] encontraron que la acción combinada de la quitinasa y la -1,3-glucanasa tiene un mejor efecto antibacterique las enzimas individuales, lo que indica que las dos enzimas tienen un efecto sinérgico al inhibir el crecimiento de bacterias patógenas. Cota et al. [65] encontraron que el efecto sinérgico de la − -1,3-glucanasa y la quitinasa puede resistir significativamente el impacto de Alternaria alternata en los tomates almacenados. Esto muestra que la -1,3-glucanasa y la quitinasa tienen un efecto sinérgico en la conservación antibacteriana post-cosecha de frutas y verduras, y tienen una capacidad antibacteriana más fuerte que una sola cepa, por lo que tienen buenas perspectivas de aplicación.
5 conclusión
Debido a que el − -1,3-glucan puede hidrolizar específicamente el − -1,3-glucan, tiene importantes perspectivas de aplicación en los campos de la preparación funcional de oligosacáridos, conservación de frutas y verduras, biomedicina y resistencia a enfermedades de las plantas. Los investigadores ya han estudiado la estructura, función y aplicación de una serie de diferentes familias − 1,3-glucanasas. En este contexto, la investigación posterior sobre las − -1,3-glucanasas se centrará en cómo obtener nuevas − -1,3-glucanasas con buenas propiedades de aplicación y conseguir una fermentación eficiente.
Sin embargo, debido a la complejidad de los sustratos naturales − -1,3-glucan, la eficiencia catalítica de las existentes − -1,3-glucanasas para diferentes tipos de sustraún necesita ser mejorada, y la hidrólienzimde algunos sustrinsolu− -1,3-glucan sigue siendo difícil. Además, la investigación sobre la estructura y la función enzimes una base importante para explorar el mecanismo catalítico de las enzimas, la minería de las propiedades catalíticas de las enzimas, y la realización de investigaciones sobre la modificación molecular de la enzima. En vista de la complejidad de los sustratos naturales − -1,3-glucan y la diversidad de las familias de − -1,3-glucanasa, es una tendencia de desarrollo para estudiar las diferencias en la Unión al sustry los mecanismos catalíticos de diferentes familias de − -1,3-glucanasa, aclarar el mecanismo de reconocimiento de sustrde − -1,3-glucanasa para moléculas complejas de glucan, y explorar un sistema catalítico de combinación de múltiples enzimas basado en la − -1,3-glucanasa con el fin de lograr la aplicación eficiente de la − -1,3-glucanasa. La 1,3-glucanasa es la tendencia de desarrollo para su aplicación eficiente.
Referencia:
[1] KADAM S U, TIWARIB K,O 'DONNELL C P. extracción, estructura y actividades biofuncionales de laminarin from Brown algae[J]. International Journal of La comidaScience and Technology, 2015, 50(1): 24-31. DOI:10.1111/ijfs.12692.
[2] MIYOSHI K, UEZU K, SAKURAI K, et al. Propuesta de una nueva forma de enlace de hidrógeno para mantener la triple héde curdlan [J]. Química & Biodiversity, 2004, 1(6): 916-924. DOI:10.1002/cbdv.200490073.
[3] Fu Yunbin, Zhao Xiaoming, Du Yuguang. Avance de la investigación sobre la actividad biológica y la aplicación del polisacárido de cydramon y sus derivados [J]. Food Science, 2012, 33(7): 315-319.
[4] SHIMIZU J,TSUCHIHASHI N, KUDOH K, et al. El curdlan dietético aumenta la proliferación de bifidobacterias en el ciego de ratas [J]. Bioscience Biotechnology and Biochemistry, 2001, 65(2): 466-469. DOI:10.1271/bbb.65.466.
[5] Yu Yonghua, Xu Feifei, Lin Lin, et al. Progreso de la investigación sobre el efecto hipolipidémico de OAT → -glucan [J]. Journal of Clinical and pathology Sciences, 2022, 42(2): 486-491. DOI:10.3978 / j.issn.2095-6959.2022.02.034.
[6] DAVIES G, HENRISSAT B. Structures and mechanisms of glycosyl hydrolases[J]. Estructura, 1995, 3(9): 853-859. DOI:10.1016/S0969- 2126(01)00220-9.
[7] ILARI A, FIORILLO A, ANGELACCIO S,et al. Estructura cristalina de una endoglucanasa Famil16 de la base hipertermófila del sustr. Reconocimiento [J]. FEBS Journal, 2009, 276(4): 1048-1058. DOI:10.1111/ j.1742-4658.2008.06848.x.
[8]YUAN Y, ZHANG X, ZHANG H, et al. Degradante GH5 − 1,3- 1,4-glucanasa PpBglu5A para glucan en Paenibacillus polymyxa KF-1[J]. Bioquímica de proceso, 2020, 98: 183-192. DOI:10.1016/ j.procbio.2020.08.008.
[9]JAAFAR N R, KHOIRI N M, ISMAIL N F, et al. funcional Caracterización y especificidad del producto de endo- − -1,3-glucanasa De la bacteria alcalofílica Bacillus lehensis G1[J]. Enzima enzima Y tecnología microbiana, 2020, 140: 109625.
[10] SHI P, YAO G, YANG P, et al. Clonación, caracterización y actividad antifúngica de una endo-1,3- − -d-glucanasa de Streptomyces sp. S27[J]. Applied Microbiology and Biotechnology, 2009, 85(5): 1483-1490. DOI:10.1007/s00253-009-2187-1.
[11]HARTL L, GASTEBOIS A,AIMANIANDAV,et al. Caracterización de la endo -1,3-glucanasa Eng2 anclgpi de Aspergillus fumigatus[J]. Fungi Genetics and Biology, 2011, 48(2): 185-191. DOI:10.1016/j.fgb.2010.06.011.
[12]DA SILVA AIRES R,STEINDORFF A S, RAMADA M H S, et al. Caracterización bioquímica de un 27 kDa 1,3- − -d-glucanasa de Trichodermaasperellum indupor la pared celular de Rhizoctonia solani[J]. Polímeros de carbohidratos, 2012, 87(2): 1219 — 1223. DOI:10.1016/ j.carbpol.2011.09.001.
[13] ISHIDA T, FUSHINOBU S, KAWAI R,et al. Estructura cristalina de glucósido hidrolasa de la familia 55 − -1,3-glucanasa del basidiomiceto Phanerochaetechrysosporium[J]. Journal of Biological Química,2009, 284(15): 10100-10109.
[14] VARGHESE J N, GARRETT T P, COLMAN P M, et al. Tres — Estructuras dimensionales de dos plantas − -glucan endohidrolasas con distintas especificidades de sustr[J]. Proceedings of the National Academy (en inglés) Of Sciences of the United States of America, 1994, 91(7): 2785-2789.
[15]ROMERO Yo, fernández-caballero C, GONI O, et al. Funcionalidad de una clase I − -1,3-glucanasa de la piel de uva de mesa Las bayas [J]. Ciencia vegetal, 2008, 174(6): 641-648. DOI:10.1016 / j.plantsci.2008.03.019.
[16] YU W Q, ZHENG G P, QIU DW, et al. Paenibacillus terrae NK3-4: un potencial agente de biocontrol que produce − -1,3-glucanasa [J]. Control biológico, 2019, 129: 92-101. DOI:10.1016/j.biocontrol.2018.09.019.
[17]LIC,WEN Y, Y, Et al. Purificación purificación Caracterización y caracterización De una novela − -1,3-glucanasa de Arca inflata y su inmune - Efectos potenciadores [J]. Food Chemistry, 2019, 290: 1-9. DOI:10.1016/ j.foodchem.2019.03.131.
[18]GAO Minjie, YAN Jiajun, ZHAO Yue, et al. Expresión de un Termoestable − 1,3-glucanasa de Trichoderma harzianum en Pichia pastoris y uso en hidrólide oligoglucósidos [J]. proceso Biochemistry, 2021, 107: 74-82.
[19]ZHANG D, SPADARO D, VALENTE S, et al. Clonación, caracterización y expresión de un gen exo-1,3- − -glucanasa de la levadura antagónica, Pichia guilliermondii cepa M8 contra el moho gris en manzanas [J]. Control biológico, 2011, 59(2): 284-293. DOI:10.1016/j.biocontrol.2011.06.018.
[20]KALYANI D C, REICHENBACH T, ASPEBORG H, et Al. Una bacteria homodimérica exo- − -1,3-glucanasa derivada del microbioma del rumen alce muestra un marco estructural similar A la levadura exo- − -1,3- Glucanasas [J]. Enzima y tecnología microbiana, 2021, 143: 109723. DOI:10.1016/j.enzmictec.2020.109723.
[21]YI P, YAN Q, JIANG Z, et al. A first glycoside hydrolase Family 50 endo- ≤ -1,3-d-glucanase from Pseudomonas aeruginosa[J]. Tecnología enzimy microbiana, 2018, 108: 34 — 41. DOI:10.1016/ j.enzmictec.2017.09.002.
[22]WANG Yanxin, ZHAO Yuqiang, WANG Xiaowen, et al. Caracterización funcional de la nueva laminaripentosa que produce − 1,3- glucanasa MoGluB y su biocontrol de Magnaporthe oryzae[J]. Journal of Agricultural and Food Chemistry, 2021, 69(33): 9571-9584.
[23] Cheng jengxiang. Expresión de − -1,3-glucanasa en Pichia pastoris [D]. Harbin: Instituto de tecnología de Harbin, 2013: 5-10.
[24] FENG Jianwei, XU Shenyuan, FENG Ruirui, et al. Identificación y Análisis estructural de una termofílica − 1,3-glucanasa de compost[J]. Bioresources and Bioprocessing, 2021, 8(1): 102-112. DOI:10.1186/ s40643-021-00449-4.
[25]MUHAMMED M T, SON C D, − ZGU F. estructura tridimensional Predicción de panomicina, una nueva exo- − -1,3-glucanasa aislada de Wickerhamomyces anomalus NCYC 434 and the computational Estudios de mutagenesis in situ dirigidos a mejorar su estabilidad térmica para aplicaciones terapéu[J]. Biología y química computacional, 2019, 80: 270-2777. DOI:10.1016/j.compbiolchem.2019.04.006.
[26]FIBRIANSAH G, MASUDA S, KOIZUMI N, et al. The 1.3 angstrom cristalstructure of a novel endo- − -1,3-glucanasa of glycoside hydrolase Family 16 from alkaliphinocardiopsis sp. strain F96[J]. Proteínas, 2007,69(3): 683-690.
[27]VUONG T V, WILSON D B. Glycoside hydrolases: base catalítica/diversidad nucleófila [J]. Biotecnología y bioingeniería, 2010, 107(2): 195-205. DOI:10.1002/bit.22838.
[28]ILARI A, FIORILLO A, ANGELACCIO S, et al. Estructura cristalina de una endoglucanasa de la familia 16 del hyperthermophile Pyrococcus furiostructural basis of substrato recognition[J]. The FEBS Journal, 2009, 276(4): 1048-1058. DOI:10.1111/j.1742-4658.2008.06848.x.
[29]ODA M, INABA S, KAMIYAN, et al. Caracterización estructural y termodinámica de endo-1,3- − -glucanasa: insights into the substrato recognition mechanism[J]. Bba-protein Proteomics, 2018, 1866(3): 415-425.
[30]JENG W Y, WANG N C, LIN C T, et al. Estructuras cristalinas de la Dominio catalítico de laminarinasa de Thermotoga maritima MSB8 en complejo con inhibide residuos esenciales para -1,3 y -1,4-glucan selección [J]. Journal of Biological Chemistry, 2011, 286(52): 45030-45040.
[31]HONG T Y, HSIAO YY, MENG M, et al. el 1.5 angstrom structure of endo-1,3- - -glucanase from Streptomyces sioyaensis: evolution of the active-site structure for 1,3- - -glucan-binding specific and hydrolysis[J]. Acta Crystallographica Section D: Structural Biology, 2008, 64: 964-970. DOI:10.1107/s0907444908021550.
[32]BLEICHER L, PRATES E T, GOMES T C F, et al. Base Molecular de la termoestabilidad y termofilicidad de las laminarinasas: estructura de rayos x de la laminarinasa hipertermoestable de Rhodothermus marinus y simulde dinámica Molecular [J]. Journal of Physical Chemistry B, 2011, 115(24): 7940-7949. DOI:10.1021/jp200330z.
[33]LABOUREL A, JAM M, JEUDY A, et al. El − -glucanaseZgLamA de Zobellia galactanivorans evolucionó un sitio activo dobladaptado para la degradación eficiente de laminarina de algas [J]. Journal of Biological Journal of Biological Chemistry, 2014, 289(4): 2027-2042.
[34]YANG J, XU Y Q, MIYAKAWA T, et al. Base Molecular para el reconocimiento de sustry catálisis por una laminarinasa bacteriana marina [J]. Applied and Environmental Microbiology, 2020, 86(23): 15. DOI:10.1128/aem.01796-20.
[35]WOJTKOWIAK A, WITEK K, HENNIG J, et al. Estructuras de un mutante del sitio activo de una planta 1,3- − -glucanasa en productos de hidrólide politogosacáridos complejos [J]. Acta Crystallographica Section D: Biological Crystallography, 2013, 69: 52-62. DOI:10.1107/s0907444912042175.
[36]RECEVEUR-BRECHO T V, CZJ ZEK M, BARRE A, et Al. Estructura cristalina a 1,45-a resolución del alérgeno principal endo- − -1,3-glucanasa del banano como base molecular para el síndrome del fruto del látex [J]. Proteínas, 2006, 63(1): 235-242.
[37]UNFRIED F, BECKER S, ROBB C S, et al. Mecanismos adaptativos que proporcionan ventajas competitivas a las bacterioidetes marinas durante floraciones de microalgas [J]. Revista ISME,2018, 12(12): 2894-2906. DOI:10.1038/s41396-018-0243-5.
[38]TAKASHIMA T, TAKU T, YAMANAKA T, et al. Estructura cristalina y caracterización bioquímica de CJP38, a -1,3-glucanasa y alérgeno del polde de Cryptomeria japonica [J]. Molecular Immunology, 2019, 116: 199-207.
[39]WU H M, LIU S W, HSU M T, et al. Estructura, acción mecánica, y residuos esenciales de una enzima GH-64, que produce laminaripentasa − -1,3-glucanasa [J]. Journal of Biological Chemistry, 2009, 284(39): 26708-26715.
[40]QIN Zhen, YANG Dong, YOU Xin, et al. El mecanismo de reconocimiento de triple hélice − 1,3-glucano por una − 1,3-glucanasa [J]. Chemical Communications, 2017, 53(67): 9368-9371. DOI:10.1039/c7cc03330c.
[41] GHOSH R, CHAKRABARTI C. Crystal Análisis estructural de NP24-I: a thaumatin-like protein[J]. Planta, 2008, 228(5): 883-890. DOI:10.1007/s00425-008-0790-5.
[42]HENRISSAT B, GARRON M L. cómo a La glucósido hidrolasa reconoce un poliglucano heli[J]. Estructura, 2017, 25(9): 1319-1321. DOI:10.1016/j.str.2017.08.004.
[43]KUMAR K, CORREIA M A S, PIRES V M R, et Novela. Insights into the degradación of − -1,3-glucansby the cellulosome (en inglés) Clostridium thermocellum revelado por estudios de estructura y función de una familia de 81 glucósido hidrolasa [J]. Revista internacional Of Biological Macromolecules, 2018, 117: 890-901. DOI:10.1016/ j.ijbiomac.2018.06.003.
[44] ZHOU Peng,CHENZhongzhou, YAN Qiaojuan, et al. La estructura de un glucósido hidrolasa de la familia 81 endo- − -1,3-glucanasa [J]. Acta Crystallographica Section D: Structural Biology, 2013, 69: 2027-2038. DOI:10.1107/s090744491301799x.
[45]MA Junwen, QIN Zhen, ZHOU Peng, Et al. Estructural insights into the substrato recognition and Catalyst mechanism of a glycoside hydrolase Family 81 − -1,3-glucanase[J] (en inglés). Enzima y tecnología microbiana, 2022, 153: 109948. [46] PLUVINAGE B, FILLO A, MASSEL P, et al. El análisis estructural de una glucósido hidrolasa de la familia 81 implica su reconocimiento de la estructura cuaternaria de -1,3- glucan [J]. Structure, 2017, 25(9): 1348-1359. DOI:10.1016/j.str.2017.06.019.
[47] BIANCHETTI C M, TAKASUKAT E, DEUTSCH S, et al. Sitio activo y Unión a laminarina en glucósido hidrolasa de la familia 55[J]. Journal of Biological Chemistry, 2015, 290(19): 11819-11832. DOI:10.1074/ JBC. M114.623579.
[48] PAPAGEORGIOU A C, CHEN J, LI D. De cristal Estructura e implicaciones biológicas de una glucósido hidrolasa de la familia 55 − -1,3- glucanasa de Chaetomium thermophilum[J]. Biochimica et Biophysica acta-protein and Proteomics, 2017, 1865(8): 1030-1038. DOI:10.1016/j.bbapap.2017.05.002.
[49] JIA X, WANG C, DU X, et al. Hidróliespecífica de curdlan con una nueva familia de glucósihidrolasa 128 − 1,3-endoglucanasa que contiene un módulo de Unión a carbohidratos [J]. Polímeros de carbohidratos, 2021, 253: 117276-117286.
[50] SANTOS C R, COSTA P, VIEIRA P S, et al. Estructural insights into -1,3-glucan cleavage by a glycoside hydrolase Family [J]. Nature Chemical Biology, 2020, 16(8): 920-929. DOI:10.1038/s41589-020- 0554-5.
[51] GASTEBOIS A, AIMANIANDA V, BACHELLIER-BASSI (en inglés) S, et al. Las proteínas solares pertenecen a una nueva familia de enzimas modificadoras de glucana involucradas en la morfogénesis de los hongos [J]. Journal of Biological Chemistry, 2013, 288(19): 13387-13396.
[52] DEJEAN G, TAMURA K, CABRERA A, et al. La sinergia entre las glicosidasas de la superficie celular y las proteínas de Unión a glucanos dicta la utilización de específicos − (1,3) -glucanos por Bacteroides[J] del intestino humano. MBio, 2020, 11(2): 1-21.
[53]YAN F, YE X L, LI C H, et al. Aislamiento, purificación, clonación genética Y expresión de proteína antifúna partir de Bacillus amyloliquefaciens MG - 3 [J]. Food Chemistry, 2 0 2 1, 3 4 9: 7. DOI: 1 0. 1 0 1 6 / j.foodchem.2021.129130.
[54] FESEL P H, ZUCCARO A.β -glucano: componente crucial de la pared celular del hongo y plantas elusivas de MAMPin [J]. Hongos genéticos y biología, 2016, 90: 53-60. DOI:10.1016/j.fgb.2015.12.004.
[55] Lou Shubao, Peng Dongjun, Wang Hui. Actividad bacteriostática de la soya → -1,3-glucanasa [J]. Journal of Heilongjiang Bayi Agricultural University, 2008 (3): 27-29.
[56] Chen Xiaoyun, Li Jianbin, Lin Ying, et al. Aplicación de -1,3-glucanasa y quitinasa en la preservación de frutas tropicales [J]. Ciencia y tecnología de la industria alimentaria, 2008(5): 294-296.
[57]RAJNINEC M, FRATRIKOVA M, BOSZORADOVA E, et al. La -1,3-glucanasa básica de Drosera binata exhibe potencial antifúnen plantas transgéde tabaco [J]. Plantas, 2021, 10(8): 1747-1762. DOI:10.3390/plants10081747.
[58]LI Kuikui, CHEN Wei, WANG Wenxia, et al. Degradación efectiva del polvo de curdlan por una nueva endo- − -1,3-glucanasa [J]. Polímeros de carbohidratos, 2018, 201: 122-130. DOI:10.1016/j.carbpol.2018.08.048.
[59] Lv Lili, Wang Ruibin, Wang Jialin, et al. Efecto de la − -glucanasa de alta eficiencia sobre la tasa de filtración del mo[J]. Brewing Science and Technology, 2010(3): 75-77. DOI:10.13746/j.njkj.2010.03.028.
[60] Lin Kaijiang, Ruan Lijuan, Wang Longying. Investigación sobre la preparación de protoplastde levadura con celulasa [J]. Boletín de ciencia y tecnología, 1996, 12(2): 118-121.
[61] Duan Huike, Xiong Shanbo, Liu Haimei. Solubilienzimde levadura − 1,3-glucano y análisis de producto [J]. Food Science, 2008, 29(1): 185-189.
[62] NETT J, LINCOLN L, marcuchillo K, et al. Papel putde los glucanos − 1,3 en la resistencia al biofilm de Candida albicans [J]. antimicrobianos Agentes y quimioterapia, 2007, 51(2): 510-520. DOI:10.1128/ aac.01056-06.
[63]MITCHELL K F, TAFF H T, CUEVAS MA, et al. Papel de la matriz − 1,3 de glucan en la resistencia antifúnde Biofilms de Candida no albicans [J]. Agentes antimicrobianos y quimioterapia, 2013, 57(4): 1918-1920. DOI:10.1128/aac.02378-12.
[64] MAUCH F, MAUCH-MANI B, BOLLER T. antifúnhydrolases en tejido de guisante: II. Inhibidel crecimiento de hongos por combinaciones de quitinasa y -1,3-glucanasa [J]. Fisiología vegetal, 1988, 88(3): 936 — 942.
[65]COTA I E, TRONCOSO — rojas R, SOTELO -MUNDO R, et al. Quitinasa y − -1,3-glucanasa enzimenzimenzim actividades in Respuesta a la infección por Alternaria alternata evaluada en dos Etapas de desarrollo en diferentes variedades de tomate [J]. científicos Horticulturae, 2007, 112(1): 42-50.
-
anterior
¿Cuál es el uso del polvo Beta Glucan en la alimentación Animal?
-
siguiente
¿Cuáles son los métodos de producción de Galacto oligosacárido (GOS)?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




