El método para la síntesis de polvo de tagatosa D?
Los humanos no pueden prescindir del azúcar en sus tres comidas diarias. Comer la cantidad correcta de azúcar no sólo satisface las necesidades del cuerpo 's funciones, pero también trae un sentido de felicidad. Senembargo, cella mejora de los niveles de vida, la gente consume demasiado azúcar, lo que ha llevado a un aumenaen la prevalencia de enfermedades como obesidad, diabetes, caries y enfermedades del corazón [1]. En los últimos años, los azúcares tradicionales de alta absorción y alacontenido calórico (como la sacarosa, el azúcar blanco, la glucosa, etc.) hansido gradualmente reemplazpor azúcares raros de baja caloría y baja absorción (como xilitol, eritritol, D-allulose, etc.). La sociedad internacional de azúcares raros (ISRS) define los azúcares raros como una clase de monosacáridos y sus derivados que existen en la naturaleza pero en cantidades muy pequeñas [3]. Los azúcares raros no sólo tienen un sabor dulce, sino que también selbajos en calorías. Más importante aún, tienen funciones fisiológicas que son beneficiosas para la salud humana y tienen grandes perspectivas de desarrollo.
Rare sugar D-tagatoseCon la fórmula molecular C6H12O6 y peso molecular 180.16, tiene la fórmula estructural que se muestra en la figura 1. Es un isómero de d-galactosa, un diastereoisómero de D-sorbitol en la posición C-3, y un diastereoisóde d-fructosa en la posición C-4. Gránulos cristalblancos o polvo blanco, fácilmente soluble en agua, ligeramente soluble en etanol. Es un edulcorfuncional natural de bajo contenido calórico con un dulzor que es 92% de sacarosa [4]y un valor calórico de 1,5 kcal/g[5]. La d-tagatosa ha sido aprobada por la administración de alimentos y medicamentos de los Estados Unidos (FDA) como un seguro (generalmente reconocido como seguro, GRAS) ingredientes [5-7]. En 2014, China's Comisión nacional de salud y planificación familiar aprobó D-tagatosecomo un nuevo ingrediente alimenticio [6]. La d-tagatosa no solo tiene el efecto de prevenir la caries dental y la obesidad y reducir el azúcar en la sangre, sino que también tiene un efecto beneficioso sobre la salud intestinal [8].
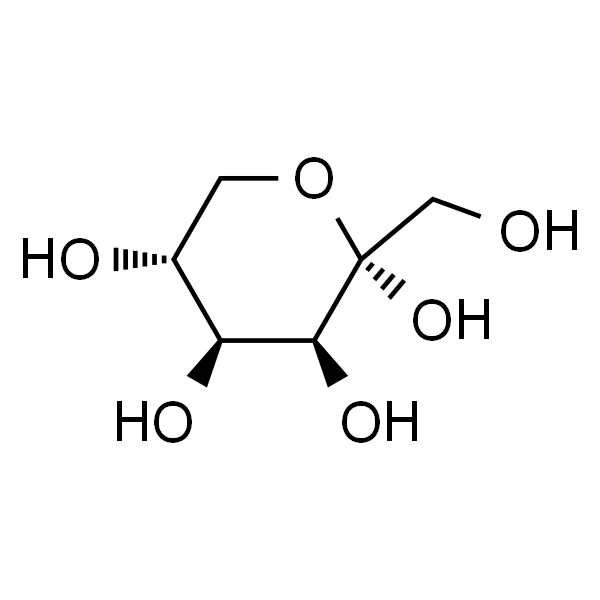
Este artículo describe brevemente las funciones fisiológicas y aplicaciones de la d-tagatosa, introduce las principales enzimas biológicas necesarias para la biosíntesis de la d-tagatosa, resume el progreso de la investigación de la D-tagatosebiosíntesis en los últimos años, y proporciona una perspectiva sobre la biosíntesis de la d-tagatosa.
1 funciones fisiológicas y aplicaciones de la D-tagatose
1.1 edulcorbajo en calorías que puede sufrir la reacción de Maillard y usarse en alimentos
D-tagatoseis a low-calorie sweetener. It is 92% as sweetas sucrose, but only 37.5% as altoin calories (4kcal/g) [5]. It canreact conproteins in food to form a Maillard reaction, which improves elcolour yflavour deelfood. It is therefore used in baked goods, drinks yconfectionery.
1.2 previene la obesidad, reduce la glucosa en sangre y ayuda en el tratamiento de la diabetes tipo 2
La d-tagatosa es un edulcorfuncional bajo en calorías que se puede utilizar en los alimentos para reemplazar a los edulcorantes tradicionales como la sacarosa. Puede aliviar la obesidad y bajar la glucemia [9]. En el campo de la medicina y la atención de la salud, la d-tagatosa se puede utilizar para preparar medicamentos para el tratamiento de la diabetes tipo 2 y la obesidad [10-12].
1.3 excelente prebiótico, beneficioso para la salud intestinal
La d-tagatosa puede ser fermentada por la flora intestinal en el colon, estimulando el crecimiento de bacterias intestbeneficie inhibiel crecimiento de bacterias patógenas en el intestino [13]. Además, la fermentación de la d-tagatosa puede producir ácidos grasos de cadena corta como el ácido butírico, que son beneficiosos para la salud intestinAl.Estos ácidos pueden promover el crecimiento y la reproducción de las células epiteliales del colon e inhibila aparición de cáncer de colon [14].
1.4 Anti-caries, beneficioso para proteger la salud dental
Debido a que la d-tagatosa no puede ser utilizada por los microorganismos en la boca, ayuda a reducir la producción de sustancias ácidas en la boca y reducir la caries dental, evitando así eficazmente la aparición de enfermedades dentales como la gingivitis, la caries dental y el mal aliento [13].

1.5 utilizado como sustrpara producir otros alcohode azúcar raros
De acuerdo con la estrategia de biotransformación para producir hexosa, es decir, la estrategia de Izumoring [15], a partir de la d-tagatosa, raros alcohode azúcar con funciones fisiológicas importantes como el D-sorbitol, d-tagatosa y galactitol pueden obtenerse mediante catálisis enzimadecuada (figura 2).
2 método de producción de D-tagatose
2.1 método de extracción Natural
La d-tagatosa en la naturaleza se encuentra principalmente en las encde los árboles perennes tropicales, musgos, líquenes, cacao caliente, queso y yogur, y el contenido es muy pequeño [13, 16, 17]. La extracción directa de d-tagatosa de estas sustancias requiere una gran cantidad de materias primas, lo que hace que el costo sea muy alto y hace que sea difícil lograr la producción industrial de D-tagatose.
2.2 método de síntesis química
La d-tagatosa se puede obtener de la d-galactosa por síntesis química. El catalizador químico utilizado es una sal de metal alcalino, que cataliza la reacción de isomeride d-galactosa con un hidróxido de metal para formar un complejo de hidróxido de metal d-tagatosa. Después de la neutralización ácida, el complejo libera d-tagatosa [13,14,18]. Sin embargo, el método de síntesis química para producir D-tagatose es relativamente complejo, y es fácil de producir subproductos, lo que reduce la pureza del producto objetivo D-tagatose y hace que sea inconveniente para separar y purimás tarde. Además, el uso de reactivos químicos causará una carga ambiental y no está en línea con el concepto de producción verde [19].
2.3 método biosintético
Hay dos maneras principales de hacerloSinted-tagatose biológicamenteUna es usar una reacción enzimúnica para sintetizar d-tagatosa, y la otra es usar una reacción multi-enzimpara sintetizar d-tagatosa. De acuerdo con la estrategia de Izumoring (figura 2), la adecuada dosis única de isomerasa, D-tagatose 3-epimerasa y reductasa puede ser seleccionada para catalizar la conversión de d-galactosa, D-sorbitol y galactitol a d-tagatosa, respectivamente. Sin embargo, los precios relativamente altos de d-galactosa, D-sorbitol y galactitol hacen difícil su aplicación en la producción industrial, limitando la producción industrial de d-tagatosa. Actualmente, algunos investigadores han elegido sustrde bajo costo como lactosa, maltodextrina y polvo de suero de leche como materiales de partida, y han utilizado una reacción catalítica multienzimpara sintetizar d-tagatosa, con algunos resultados de investigación obtenidos. El método biosintético de producción de d-tagatosa tiene las ventajas de alta eficiencia de producción, alta pureza del producto, condiciones de reacción suaves, y bajo costo, por lo que es el método preferido para la producción industrial de d-tagatosa [20].
3 síntesis de d-tagatosa por reacción enzimsimple
3.1 l-arabinosa isomerasa cataliza la síntesis de d-galactosa a d-tagatosa
El método de una sola enzima de biosíntesis de azúcares raros puede explotar plenamente las propiedades fisicoquímicas de la enzima y se aplica en la producción de azúcares raros. Tiene las ventajas de ser simple y eficiente, alta utilización del catalizador enzim, y alta eficiencia de producción. La l-arabinosa isomerasa (L-AI) es actualmente la enzima más estudipara la biosíntesis de d-tagatosa, y puede catalizar d-galactosa a d-tagatosa.
Esta enzima tiene una amplia gama de fuentes microbi, incluyendo AcidothermuscelulolíticosATCC43068[21], bacibacibacibacibacibacibacibacibacibacibacibacibacibacibacibacisubtilis STR. 168[22], Lactobacillus sake i 23K[23], Lactobacillus fermentum CGMCC2921[24], Bacillus thermoglucosidasius KCTC 1828[25], Alicyclobacillus Hesperidum URH17-3-68[26], bacibacibacibacibacibacibacibacibacibacibacibacibacibacibacibacicoagulans NL01[27], Pseudoalteromonas haloplanktis ATCC14393[28], Geobacillus Stearothermophilus [4], Clostridium hylemonae DSM 1505 3[29], Lactobacillus brevis MF 465792[30], Enterococcus faecium DBFIQ E36[31], Bifidobacterium adolescentis CICC 6178[32], Klebsiella pneumoniae DSM 681[33], etc.
The enzymatic properties deL-arabinoseisomerasadesdeelabove microorganisms are shown in Table 1. The optimum reaction temperature is between 40-75 ℃, eloptimum reaction pH is between 5.0-8.0, yvarious metal ions are activators dethe enzyme, such as Mn2+, Co2+, and Mg2+. Most L-AIs have substrateespecificidadparaL-arabinoseand D-galactose, while a small number have substrate specificity only paraL-arabinoseand no substrate specificity paraD-galactose, such as L-AIs desdeBacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. specificity, such as L-AI desdeBacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. In addition, L-AI enzymes desdeAcidothermus cellulolytics ATCC43068[21], Lactobacillus sakei 23K[23], Lactobacillus fermentum CGMCC2921[24], Bifidobacterium adolescentis CICC 6178[32], etc. exhibit strong substrate specificity paraD-galactose.
La L-AI de Bacillus coagulans NL01 fue expresada heteren un sistema de expresión de E. coli y catalizada por células enteras a 60 °C y pH 7,5. Cuando la concentración del sustrd-galactosa fue de 150 g/L y 250 g/L,las tasas de conversión de la d-tagatosa resultante fueron de 32% y 27%, respectivamente, y los tiempos de conversión fueron de 32 y 48 h, respectivamente [27]. La tasa de conversión de D-tagatose fue de 56,7% cuando 100 mmol/L de d-galactosa (que contiene 6 mmol/L de Mn2+) fue catalizada por la enzima L-AI puride Bifidobacterium adolescentis CICC 6178 a 55 °C y pH 6,5 para 10 h [32]. La L-AI de Klebsiella pneumoniae DSM 681 fue expresada de forma heterogénea en un sistema de expresión de E. coli. El sustrfue 100 g/L de d-galactosa (conteniendo 1 mmol/L de Mn2+). La reacción catalítica de célula entera se llevó a cabo a 50 °C y pH 8,0 durante 30 min, y la tasa de conversión de D-tagatose fue de 33,5% [33].
La tecnología de visualización de la superficie de la espora es un método que se basa en el efecto de anclde la proteína de la capa de la espora para mostrar la enzima objetivo en la superficie de la espora mediante la fusión de la enzima objetivo con la proteína de la capa de la espora, lo que inmoviliza la enzima. Las enzimas inmovilizpueden mantener la actividad catalítica en ambientes extremos y superar la barrera del sustrato y la permedel producto a través de la membrana [10]. Es un intento beneficioso de inmovilización enzim. En 2014, LIU [16] usaron la tecnología de visualización de la superficie de las esporas para mostrar la enzima L-AI de Lactobacillus fermentum CGMCC2921 en la superficie de las esporas de Bacillus subtilis 168. Las esporas de L-AI recombinobtenidas mostraron una actividad catalítica relativamente alta y una fuerte estabilidad térmica. Después de ser almacenados a 80 °C durante 30 min, aún conservaban el 87% de su actividad enzim.
Utilizando esta espora de L-AI recombincomo biocatalizador, se utilizó como sustr100 g/L de d-galactosa, y la reacción se llevó a cabo a 70 °C durante 24 h, con una tasa de conversión de d-tagatosa de alrededor del 75%. En 2018, GUO etAl.[10] también usaron la tecnología de visualización de la superficie de las esporas para mostrar la enzima L-AI derivada de Lactobacillus brevis PC16 en la superficie de las esporas de Bacillus subtilis DB403. Las esporas de L-AI recombinfueron utilizadas como biocatalizadores. Utilizando 125 g/L de d-galactosa (conteniendo 1 mmol/L de Mn2+) como sustr, la reacción se llevó a cabo a 6 7 °C y pH 6,5 durante 28 h. La tasa de conversión de d-tagatosa fue de 79.7%, y las esporas de L-AI recombinantes tuvieron buena reutilización. Después de 5 ciclos, la actividad específica seguía siendo del 87%, y la tasa de conversión de D-tagatose era del 40,7%. La tecnología de visualización de superficie de esporas tiene la desventaja de un bajo rendimiento de esporas, lo que dificulta su aplicación industriAl.La tabla 2 resume los informes mencionados anteriormente sobre la síntesis catalítica de d-tagatosa a partir de d-galactosa.
Debido a las limitaciones del equilibrio termodinámico, las reacciones catalizadas por isomerasa se caracterizan por bajas tasas de conversión, lo que reduce la eficiencia de producción y no es propicio para la separación y purificación de productos. Aunque el aumento de la temperatura de reacción puede cambiar el equilibrio de reacción hacia el lado del producto, las temperaturas excesivamente altas no sólo reducen la actividad enzim, sino que también conducen fácilmente al oscurecimiento del azúcar, afectando la calidad del producto, especialmente en condiciones alcalinas. Por lo tanto, el desarrollo de un catalizador enzimático con baja temperatura de reacción, pH de reacción ácido, alta actividad catalítica y fuerte resistencia al calor será beneficioso para aplicaciones industriales.
La 3-epimerasa 3,2 cataliza la producción de d-tagatosa a partir de D-sorbitol
La d-tagatosa-3-epimerasa (d-tagatosa-3-epimerasa, DTE) o D-psicose 3-epimerasa (D-psicose 3-epimerasa, DPE) son enzimas de uso común para la biosíntesis de D-psicose. Tienen un amplio rango de especificidades de sustr. Por ejemplo, las enzimas DPE de Agrobacterium tumefaciens[34] y Arthrobacter globiformis[35] y la enzima DTE de Caballeronia fortuita[36] todos pueden convertir entre D-sorbitol y D-Tagatose, en el que la relación de D-Tagatose a D-sorbitol en el equilibrio es 30.7:69.3 cuando biocatalizada por la enzima DTE de Caballeronia fortuita (figura 3)Producción industrial de D-tagatose desdeD-sorbitol uneconomical.
3. 3 Galactitol deshidrogenasa cataliza la producción de d-tagatosa de Galactitol
Galactitol 2-deshidrogenasa (GDH) puede oxidar varios polialcoholes y polioles a las cetonas correspondientes y cetosis, respectivamente, en presencia de la coenzima NAD+. JA GTAP,etc. [37] expresó de manera heterogénea la enzima GDH de Rhizobium leguminosarum BV. Viciae 3841 en un sistema de expresión de E. coli.
La proteína de la enzima GDH fue puriusando cromatode afinhis-tag. La electroforesis en gel de gel de dodecilo sódico y poliacrilamida se utilizó para determinar el peso molecular de la enzima en 28 kDa, yla cromatode filtración en gel se utilizó para determinar el peso molecular de la enzima en 114 kDa, lo que indica que la enzima es un homotetrámero. El análisis de las propiedades enzimmostró que la temperatura óptima es de 35 °C y el pH óptimo de reacción es de 9,5. Cuando el sustres galactitol, los parámetros cinéticos Km son 8.8 mmol/L, Kcenson 835 min-1, y Kcat/Km son 94.9 min-1mmol·L-1, lo que indica que la enzima tiene una buena especificidad de sustrpara galactitol. La enzima G DH cataliza la reacción de galactitol durante 30 min, y la tasa de conversión de D-tagatose es tan alta como el 72%. Se verifica mediante la medición de la rotación óptica que el producto de oxides d-tagatosa.
Aunque la tasa de conversión de D-tagatose alta se puede obtener mediante la catalización de la producción de D-tagatose de galactitol usando galactitol deshidrogenasa, pero esta reacción de oxidrequiere la adición de la coenzima NAD+, y el sustrgalactitol es caro, por lo que no es económico como una materia prima para la producción industrial.
4 Catalizar la síntesis de d-tagatosa a partir de sustrde bajo costo por catálisis multienzim.
4. 1 Catalizar la producción de d-tagatosa a partir de lactosa
La lactosa es un disacárido compuesto por una molécula de D-glucosa y una molécula de d-galactosa. Debido a que su precio es mucho menor que el de la d-galactosa, D-sorbitol y galactitol, es el sustrpreferido para la producción de d-tagatosa. Zhang etAl.[38] construyeron un Lactiplantibacillus plantarum Ingeniero cepa, noqueando el gen galactoquinasa para bloquear el metabolismo de d-galactosa; También expresa − -galactosidasa (− -g galactosidasa, − -GAL) y l-arabinosa isomerasa, que cataliza d-galactosa a d-tagatosa, logrando así la biosíntesis directa de d-tagatosa a partir de lactosa en un recipiente.
4. 2. Producción catalítica de d-tagatosa a partir de polvo de suero
Los residuos de la industria láctea se utilizan como materia prima barata para producir productos de azúcar raros [39,40]. En 2022, ZHANG ZHANGZHANGetAl.[41] informaron de la conversión de un subproducto lácteo rico en lactosa, polvo de suero de queso (CWP), en tres edulcorantes bajos en calorías, D-tagatose, D-arabitol y galactitol, mediante catálisis y fermentación continua de células enteros (Fig. 4). Posteriormente, la D-glucosa y el resto de d-galactosa son fermentados por Metschnikowia pulcherrima E1 a D-arabitol y galactitol. Finalmente, 68,35 g/L de d-tagatosa,60,12 g/L D-arabitolSe obtuvieron 28,26 g/L de galactitol y 428,57 g/L de CWP (conteniendo 300 g/L de lactosa). Este informe también logró la plena utilización de los metabolitos intermedios D-glucosa y d-galactosa residual, produciendo una serie de productos valiosos a partir de subproductos industriales.
4.3 producción catalítica de d-tagatosa a partir de maltodextrina
20 22 años, DAI etAl.[42] construyeron un sistema compuesto de − -glucan fosforilasa (− -glucan fosfoliasa, − GP), fosfoglucomutasa (PGM), glucosa 6-fosfato isomerasa (PGI), D-tagatose 1, 6-bisfosfato aldolasa (GatZ), y fosfoglicolato fosfatasa (PGP). Fosfatasa (PGP) compuesta por un biocatalizador de célula entera de Escherichia coli. La tecnología CRISPR-Cas9 se utilizó además para eliminar el gen que causa el metabolismo del producto intermedio (figura 5), con el fin de aumentar la acumulación del producto intermedio. La cepa de E. coli resultante fue utilizada como biocatalizadores para obtener 3,383 g/L de d-tagatosa con una tasa de conversión de 33,83 g/L usando 10 g/L de maltodextrina como sustrdurante 3 h.
Multienzyme promoted reactions have great potential in terms debiosynthesis and conversion. Compared with single-enzyme-promoted reactions, multi-enzyme-promoted reactions can achieve more complex reactions, producciónhigh value-added products desdelow-cost substrates, avoid the separaciónof intermediates, reduce the inhibition of intermediates, and even change the reaction balance [5]. However, due to the unbalanced ratio of various enzymes, the unbalanced metabolic flux of intermediates, and the different optimal reaction conditions of various enzymes, the conversiónrate De D-tagatoseis not high. In the later stage , it is possible to use techniques such as synthetic biology, metabolic engineering, and protein engineering to optimize enzyme synthesis and Expresión,improve enzyme performance, increase the synergy between various enzyme molecules, and improve the conversion rate of D-tagatose.
5 D -tagatose separación, purificación y cristalización
La separación y purificación de la d-tagatosa es un paso crucial que afecta la posterior cristde la d-tagatosa y la calidad del producto. En 2008, Huang Wenxia etAl.[43] informaron el uso de resina de intercambio iónico de Ca2+ para separar la d-galactosa y la d-tagatosa, y la pureza de la d-tagatosa obtenida fue de 98%, y la tasa de recuperación fue de 83%; La solución de d-tagatosa obtenida fue luego sometida a aniones y resinas de intercambio catiónico para la desalinización y decoloración, con una tasa de desalinide 93% y una tasa de recuperación de D-tagatose de 87%. Posteriormente, la d-tagatosa se cristalizó mediante la adición de etanol. Su Qi etAl.usaron cromatode lecho móvil simulada para separar la d-tagatosa y la d-galactosa y encontraron que cuando el tiempo de cambio de válvula era de 6,43 min, la pureza de la d-tagatosa obtenida por separación alcanzaba el 100%, y la tasa de recuperación alcanzaba el 99.93% [44]. En los últimos años, la cromatode lecho móvil simulada ha sido ampliamente utilizada en la producción de azúcares raros debido a sus ventajas de alta eficiencia de separación, alta utilización de disolventes y bajo consumo de energía.
At present , there have been few reports on the cristcristcristcristof D-tagatose. The biosynthesis De D-tagatoseis prone to the producciónof other heterosaccharides (such as D-glucose, D-fructose, etc.), and they often cannot be completely removed during industrial separation, which affects the nucleation and growth of D-tagatose crystals, as well as the morphology, particle size distribution and purity of D-tagatose crystals. In 2022 , WANG WANGetal. [45] studied the effect of three impurity azazúcares(D-maltose, D-fructose, and D-glucose) on the nucleation rate of D-tagatose crystals and found that the adsorption De la impurezasugars on the surface of D-tagatose crystals hinders the growth of D-tagatose crystals (Figure 6). WANG et al. also studied the effect of impurity sugars on the growth rate of D-tagatose crystals through single crystal growth experiments, and used molecular dynamics simulations to reveal the crystal nucleation and growth mechanism of D-tagatose at the molecular scale. There are currently few reports on the industrial crystallization process of D-tagatose.
6 resumen y perspectivas
As a functional natural sweetener, D-tagatose not only has important application value in the food industry, but also plays a vital funciónin the pharmaceutical and healthcare industries. Although D-tagatose has been approved as a new food ingredient in China, large-scale production has not yet been realized for the following reasons: (1) an enzyme catalyst with high production intensity, strong thermal stability and high conversion rate has not yet been obtained; (2) insufficient development of food-grade host bacteria; (3) high substrate cost; (4) high difficulty in product separation and purification.
(1) utilizar ingeniería de proteínas, ingeniería enzimática y otras tecnologías para modificar la estructura molecular de las enzimas a fin de obtener moléculas enzimáticas con alta actividad catalítica, alta tasa de conversión y alta estabilidad térmica; (2) desarrollar bacterias hospedadoras de calidad alimentaria con certificación GRAS como portadores biocatalizadores, incluidos Bacillus subtilis, levaduras, bacterias del ácido lác, etc.; (3) dar pleno desarrollo al potencial de la catálisis multienzimen la biosíntesis y transformación, equilibrar los niveles de expresión de varias moléculas enzimáticas y el flujo del metabolismo intermedio, aumentar el efecto sinérgico entre varias moléculas enzimáticas, y utilizar sustrde bajo costo para producir D-tagatose en masa; (4) optimizar los procesos de separación, purificación y cristalización de la d-tagatosa. A través de los esfuerzos anteriores, se ha establecido una ruta de proceso simple, eficiente e innovadora para la producción industrial de D-tagatose.
Referencia:
[1] SURAPUREDDI I, II, III, IV Et al. Métodos analíticos de alta resolución y alto rendimiento para la di-tagatosa y impurezas relacionadas con procesos utilizando electroforesis capilar [J]. Analytical Biochemistry, 2020, 609: 11398 1.
[2] BAPTISTA S,Rumania, OLIVEIRA C,et al. Galactosa to tagatose isomerizaciónby the L-arabinoseisomerasafrom Bacillus subtilis: a biorrefinery approach for gelidium sesquipedale valorisation[J]. LWT-Food Science and Technology, 15, 2021,151: 112199.
[3] BEERENS K, DESMET T,SOETAERT W. enzimas para la producción biocatalítica de azúcares raros [J]. Journal of Industrial microbiologíaand Biotechnology, 2012, 39(6): 823-834.
[4] LAKSMI F, ARAI S, TSURUMARU H, et al. mejorado substrate specificity for d-galactosa of L-arabinose isomerasa for Aplicación industrial [J]. Biochimica et Biophysica Acta (BBA) - protein and Proteomics, 2018, 1866(11): 1084-1091.
[5] DAI Y,LIM,JIANG B, et al. Biosíntesis de células completas de d-tagatosa a partir de maltodextrina por ingeniería de Escherichia coli con sistema de coexpresión multienzim[J]. Enzima y tecnología microbiana, 2021, 145: 109747.
[6]WANG J. producción de edulcord-tagatosa y su aplicación en alimentos [J]. China Condiment, 2016, 41(01): 140-143.
[7] ROY S, CHIKKERUR J,ROY S, et Al. Tagatose as a potential nutraceutical: producción, características, papeles biológicos, y aplicaciones [J]. Journal of Food Science, 2018, 83(11): 2699-2709.
[8] LAKSMI F, ARAI S, ARAKAWA T,et al. Expresión y caracterización de l-arabinosa isomerasa de Geobacillus stearothermophilus para mejorar la actividad en condiciones ácidas [J]. Expresión y purificación de proteínas, 2020, 175: 105692.
[9] BOBER JR, NAIR NU. galactosa to tagatose isomerization at moderado temperaturas with high conversion and Productividad [J]. Nature Communications, 2019, 10(1): 4548.
[10] GUO Q,AN Y,YUN J, et al. Aumento de la producción de d-tagatosa por la superficie de las esporas l-arabinosa isomerasa a partir de Lactobacillus brevis PC16 aislado y biotransformación [J]. Bioresource Technology, 2018, 247: 940 -946.
[11] DESOUSA M, MELO V, HISSA D,et al. Inmovilización y estabilización de un paso de un Enterococcus faecium DBFIQ E36 L- arabinosa isomerasa para la síntesis de D-tagatose [J]. AppliedBiochemistry and Biotechnology, 2019, 188(2): 310 -325.
[12] DE SOUZA T,OLIVEIRA R,BEZERRA S, et al. Expresión alternativa heteróloga de l-arabinosa isomerasa de Enterococcus faecium DBFIQ E36 por inducde lacde de suero residual [J]. Molecular Biotechnology, 2021, 63(4): 289 -304.
[13] DAI Y. biosíntesis de d-tagatosa a partir de maltodextrina por sistema catalítico multienzim[D]. Universidad Jiangnan, 2021.
[14] GUO Q. la producción de D-tagatose a partir de lactosa usando − -galactosidasa y l-arabinosa isomerasa [D]. Universidad de Shandong, 2018.
[15] IZUMORI K. Izumoring: a strategy for bioproduction of all hexoses[J]. Journal of Biotechnology, 2006, 124 (4): 717-722.
[16] LIU Y, LIS, XU H,et al. Producción eficiente de d-tagatosa utilizando un sistema de pantalla de superficie apto para alimentos [J]. Journal of Agricultural and Food Chemistry, 2014, 62(28): 6756-6762.
[17] ZHENG Z, XIE J, LIU P,et al. Elegante y eficiente biotransformación para la producción dual de d-tagatosa y bioetanol a partir de polvo de suero de queso [J]. Journal of Agricultural and Food Chemistry, 2019, 67(3): 829 -835.
[18] WANG Z, WANG M, LYU X,et al. Preparación de reciclaje de tagatosa de alta pureza a partir de galactosa utilizando adsoradsorcon isomeriasistida por adsory purificación simultánea [J]. Chemical Engineering Journal, 2022, 446: 137089.
[19] BORTONE N, FIDALEO M. estabilización De los inmovilizados L-arabinose isomerasa for the production of D-tagatose from D-galactosa [J]. Biotechnology Progress, 2020, 36(6): e3033.
[20] DE SOUSA M, SILVA GURGEL B, PESSELA B, et al. Preparación de CLEAs y CLEAs magnéticas de una isomerasa L -arabinosa recombinante para la síntesis de d-tagatosa [J]. Enzima y tecnología microbiana, 2020, 138: 109566.
[21] CHENG L, MU W, ZHANG T, et al. An L-arabinose isomerasa from Acidothermus cellulolytics ATCC 43068: Clonación, Expresión, purificación y caracterización [J]. Applied Microbiology and Biotechnology, 2010, 86(4): 1089 -1097.
[22] KIM J, PRABHU P, JEYA M, et al. Caracterización caracterización caracterización of an L-arabinose isomerasa from Bacillus Subtilis [J]. Applied Microbiology And Biotechnology, 2010, 85(6): 1839-1847.
[23] RHIMI M, ILHAMMAMI R, BAJIC G, Et al. La l-arabinosa isomerasa tolerante al ácido de la Lactobacillus sakei 23K es un atractivo productor de d-tagatosa [J]. Bioresource Technology, 2010, 101(23): 9171 -9177.
[24] XU Z, QING Y, LI S, et al. A Novela novelal-arabinosa isomerasa de Lactobacillus fermentum CGMCC2921 para la producción de D-tagatose: clonación de genes, purificación y caracterización [J]. Journal of Molecular Catalysis B: enzim, 2011, 70(1): 1 -7.
[25] SEO M. Caracterización caracterización caracterización of an L-arabinose isomerasa from Bacillus thermoglucosidasius for D-tagatose Producción [J]. Bioscience Biotechnology and Biochemistry, 2013, 77(2): 385-388.
[26] FANC, LIU K, ZHANG T, et al. Caracterización bioquímica de una l-arabinosa isomerasa termoestable de una bacteria termoacidófílica, alicyclobacihesperidum URH17-3-68[J]. Journal of Molecular Catalysis B: enzim, 2014, 102: 120-126.
[27] MEI W,WANG L, ZANG Y, et al. Caracterización de una l-arabinosa isomerasa de Bacillus coagulans NL01 y su aplicación para la producción de d-tagatosa [J]. BMC Biotechnology, 2016, 16(1): 55.
[28] XU W, FAN C, ZHANG T, et al. Clonación, expression, and Caracterización caracterización caracterización De un novel L-arabinose isomerasa from the Bacteria psicrotolerante Pseudoalteromonas haloplanktis[J]. Molecular Biotechnology, 2016, 58(11): 695-706.
[29] NGUYEN T, HONG HONG HONG HONG HONG HONG HONG HONG HONG HONG HONG HONG HONG HONG M, CHANG P, et al. Propiedades bioquímicas De l-arabinosa isomerase from Clostridium hylemonae to produce D- tagatosa como edulcorfuncional [J]. PLoS One, 2018,13(4): e0196099.
[30] DU M, ZHAO D, CHENG S, et al. Hacia la conversión enzimeficiente de d-galactosa a d-tagatosa: purificación y caracterización de l-arabinosa isomerasa de Lactobacillus brevis[J]. Bioprocess and Biosystems Engineering, 2019, 42(1): 107 -116.
[31] MANZO R, ANTUNES A, DE SOUSA M, et al. bioquímica Caracterización caracterización caracterización Recombinante tolerante al calor L-arabinose isomerase A partir de la cepa de Enterococcus faecium DBFIQ E36 con posibles aplicaciones en la producción de d-tagatosa [J]. Molecular Biotechnology, 2019, 61(6): 385-399.
[32] ZHANG G, AN Y, PARVEZ A, et al. Explorar una l-arabinosa isomerasa altamente específica de d-galactosa de Bifidobacterium adolescentis para la producción de d-tagatosa [J]. Fronteras en bioingeniería y biotecnología, 2020, 8: 377.
[33] SHIN K, SEO M, KIM S, et al. Caracterización de la l-arabinosa isomerasa de Klebsiella pneumoniae y su aplicación en la producción de d-tagatosa a partir de d-galactosa [J]. Ciencias aplicadas, 2022, 12(9): 4696.
[34] KIM H, HYUN E, KIM Y, Et al. Caracterización de una agrobacteria tumefaciens D-psicose 3-epimerasa que convierte d-fructosa en D-psicose [J]. Applied and Environmental Microbiology, 2006, 72(2): 981 -985.
[35] YOSHIHARA A, KOZAKAI T, SHINTANI T, et al. Purificación y caracterización de la d-celulosa 3-epimerasa derivada de Arthrobacter globiformis M30, un microorganismo GRAS [J]. Journal of Bioscience and Bioengineering, 2017, 123(2): 170 -176.
[36] LI S, CHEN Z, ZHANG W, et al. Caracterización de una d-tagatosa-3-epimerasa de Caballeronia fortuita y su aplicación en la producción de azúcar rara [J]. International Journal of Biological Macromolecules, 2019,138: 536 -545.
[37] JAGTAP S, SINGH R, KANG Y, et al. Clonación y caracterización de una galactitol 2-deshidrogenasa de Rhizobium legumenosarum y su aplicación en la producción de D-tagatose [J]. Tecnología enzimy microbiana, 2014, 58 -59: 44-51.
[38] ZHANG S, GUO T, XIN Y, et al. Producción biotecnológica de D-tagatose a partir de lactosa usando ingeniería metabólica Lactiplantibacillus plantarum[J]. LWT - ciencia y tecnología de los alimentos, 2021, 142: 110995.
[39] RAI S, KAUR H, KAULDHAR B, et al. Cristal híbrido de metal de doble enzima para la transformación directa de lactosa de suero en un azúcar raro de alto valor D-tagatose: síntesis, caracterización, y un proceso sostenible [J]. ACS Biomaterials Science and Engineering, 2020, 6(12): 6661-6670.
[40] ZHANG G, ZABED H, YUN J, et al. Biosíntesis de dos etapas de D-tagatose a partir de polvo de suero de leche por una cepa de Escherichia coli que expresa l-arabinosa isomerasa de Lactobacillus plantarum[J]. Bioresource Technology, 2020, 305: 123010.
[41] ZHANG G, ZABED H, AN Y, Et al. Conversión biocatalítica de un residuo lácrico en lactosa en D-tagatose, D-arabitol y galactitol utilizando tecnologías secuenciales de células completas y de fermentación [J]. Bioresource Technology, 2022, 358: 127422.
[42] DAI Y, LI C, ZHENG L, et al. Biosíntesis mejorada de D-tagatose a partir de maltodextrina a través de ingeniería de vías modulares de Escherichia coli recombin[J]. Revista de ingeniería bioquímica, 2022, 178: 108303.
[43] HUANG W, MU W, JIANG B. estudio sobre la separación y purificación de D -tagatose[J]. Food and fermentación Industries, 2008, 34(06):168-171.
[44] SU Q, LI H, ZHA X, et al. simulación estudio on separation of D-tagatose and d-galactosa in simul Movimiento en movimiento Bed [J]. Contemporary Chemical Industry, 2014, 43(07): 1379-1381+1385.
[45] WANG D, WANG Y, LI Y, et al. El descubrimiento the role of impurity sugars on the crystallization of D-tagatose Cristal: experimentos Y simulaciones de dinámica molecular [J]. Food Chemistry, 2022, 397: 133762.
-
anterior
¿Cuáles son los usos de la D tagatosa?
-
siguiente
¿Cuáles son los beneficios de la D tagatosa?


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




