Cómo sintetizar el extracto de Ginkgo ácido ginkgólico?
Ginkgo bilobunL. is eloldest living tree species on elplanetyis known as el“golden living fossil”. As a únicoeconomic gymnosperm enChina, it has multiple values as food (white fruit), medicine (leaves ywhite fruit) yornamental plants. Ginkgo nuts (seeds) are a famous health-promoting dried fruit enChina. As a food conmedicinal properties with high nutritional value, the ginkgolides contained enit are potential activoingredients against the 2019-nCoV virus[1]. Ginkgo biloba leaves are rich enflavonoids ylactones. Extraction deGinkgo biloba (EGB) with acetone-water as the extracting agent can further enrich the two active substances aeffectively treat cardiovascular ycerebrovascular diseases [2]. Ginkgo biloba is a world-famous ornamental tree for landscaping with its unique leaf shape, golden leaf color yupright tree shape. At present, ginkgo has been extensively developed enthe pharmaceutical, food, cosmetics, bonsai and timber industries, and is one dethe key economic tree species for the current and future revitalization dethe rural economy and the construction dea beautiful China.
Desde la década de 1970, China's ginkgo recursos han crecido rápidamente, y los recursos existentes representan más del 80% del mundo#39;s total. Los árboles de Ginkgo se distribuyen en todas las provincias (incluyendo las introducidas desde otros lugares), a excepción de Hainan, Heilongjiang y Mongolia interior. En la actualidad, el área cultivada de ginkgo en China es de más de 333.300 HM2, con una producción anual de cerca de 11.000 toneladas de nueces de ginkgo y 10.000 toneladas de hojas verdes secas. El valor de la producción anual de la industria primaria del cultivo del ginkgo es de unos 2 mil millones de yuanes, y la industria secundaria del procesamienadel ginkgo y la producción farmacéutica (medicina de la hoja de ginkgo) vale más de 10 mil millones de yuanes.

Senembargo, alrededor de 30.000 toneladas de capas de semillas exteriores se desechan cada año debido a la producción. Zhang Xinhui et al. [3] mostraron que la capa exterior de la semilla contiene sustancias activas tales comoginkgolic acid, flavonoids, terpene lactones and polysaccharides. Itokawa et al. [4] showed that ginkgolic acid is another important active substance enginkgo biloba, in addition aginkgolide and ginkgoflavone. It has bactericidal, bacteriostatic, anti-inflammatory, anti-viral, insect repellent and insecticidal effects, and is degreat value for development. Therefore, the large amount dediscarded outer seed coats not only pollutes the environment but also causes a waste of resources.
En la década de 1970, Gellerman et al. [5-7] detectaron el ácido fenóginkgolide de las hojas de ginkgo, las semillas inmaduras y las capas externas maduras de las semillas. Las mediciones cuantitativas posteriores mostraron que el ginkgolide se concentra en las capas de semillas externas maduras. Wang Jie et al. [8] y Li Hongqing et al. [9] usaron espectrode masas para identificar cuatro ácidos ginkgolicos y dos ginkgolidos de extractos ácidos de ginkgo. La investigación médica moderna ha demostrado que los ginkgolides tienen cierta toxicidad alergénica y citotoxicidad, pueden resistir el crecimiento de bacterias y hongos, y tienen el efecto de matar plagas.
Los experimentos de cultivo de campo han demostrado que los ginkgolidos pueden ser desarrollados como biopesticidas, y pueden ser utilizados en una amplia gama de campos como la medicina y la cosmética en el futuro. Sin embargo, en comparación con sustancias con claras actividades farmacológicas como los flavonoides ginkgo y las lactonas terpen, la vía de biosíntesis, el mecanismo regulador y la eficacia derivada del ácido ginkgólico no han sido estudiados en profundidad, lo que ha retrasla investigación y el desarrollo de técnicas de biología molecular para inhibir la síntesis del ácido ginkgólico y la aplicación de ingeniería de la fermentación para producir altos rendimientos de ácido ginkgólico, Así obstaculizel desarrollo posterior de la industria del ginkgo.

En vista de ello, el autor resume la investigación básica sobre la actividad biológica de ginkgolides en los últimos años, detalla la vía de síntesis de ginkgolides, que se compone de la síntesis de ácidos grasos y la síntesis de poliquetida, resume el mecanismo catalítico de las enzimas clave involucradas en la síntesis, y mira hacia el futuro de la investigación en la dirección, con el objetivo de proporcionar referencia y apoyo teórico para la investigación posterior sobre ginkgolides.
1 actividad biológica de ginkgolides
El ácido ginkgolida pertenece a la familia de los lípidos fenó, que tiene cuatro categorías principales: alquilfenoles, alquilresorcinoles, ácidos anacárdicos y alquilcatecolos [10]. Son una clase de metabolitos secundarios en plantas. Diferentes especies de plantas pueden contener sustancias fenóúnicas. Su principal función fisiológica es resistir los estresbióticos y abióticos.
1.1 composición del Ginkgolide y propiedades físicas y químicas
Los ginkgolida son importantes metabolisecundarios del ginkgo biloba, y pertenecen a la clase de lacas. Incluyen tres componentes: ácido ginkgólico, ginkgol y bilobol [11]. El ácido ginkgólico es un ácido 2-hidroxi6-alquenilo (alquinil) benzoico (Fig. 1a) con una longitud de cadena lateral de 13, 15, o 17 y un doble número de enlace de cadena lateral de 0 a 2. Un total de cinco tipos han sido aislados e identificados, A saber, ácido ginkgolic B, ácido ginkgolic A, ácido ginkgolic, heptadec-1-enylginkgolic ácido y heptadec-1-dienylginkgolic ácido. Los ginkgolidos son 3-alkenilfenoles con una longitud de cadena lateral de 15 o 17 y una cadena lateral doble cuenta de enlace de 1, y hay dos tipos en total; Los ácidos ginkgólicos son 5-alquilresorcinoles con una longitud de cadena lateral de 15 o 17 y un doble enlace de cadena lateral de 2 (Fig. 1b), y hay dos tipos en total.
Plants such as geranium(Pelargonium hortorum) in the Geraniaceae family [12] and sumac (Anacardium occidentale) in the Anacardiaceae family [13] also contain urushiolic acids. The alkyl/alkenyl side chain lengths and the number of unsaturated bonds, and so on, but the chemical structure is similar to that of ginkgolides. Ginkgolic Ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidosare the main substances in ginkgolides extract, accounting for 90% of the entire acidic extract. The proportions of the five ginkgolic acids are different, mainly including ginkgolic acid (50% content), followed porheptadec-1-enyl ginkgolic acid (22%) and ginkgolic acid (20%) [14] (Figure 2). With the development of science and technology, ginkgo acid has been detected in ginkgo leaves, outer seed coats and kernels. The total ginkgo acid content of ginkgo leaves from different varieties (strains) is about 14.5765-23.6813 mg/g [15], and the total ginkgo acid content of mature kernels is about 0.11 mg/g [14]. and the total ginkgolic acid content in the outer seed coat can reach 28.78 mg/g [16].
The melting point of ginkgolic acid is 41-42°C. At room temperature, pure ginkgolic acid is oily or powdery in appearance, and is poorly soluble in polar solvents such as water or ethanol, but easily soluble in non-polar solvents such as light petroleum ether. It precipitates as crystals in saturated petroleum ether solvent [17]. In solution, the hydroxyl and carboxyl groups on the phenolic acid benzene ring ionize to produce a weak acid, which can undergo esterification and saponification reactions. Ginkgolic acid that has undergone esterification or saponification is easier to extract and separate, achieving the effect of purification. The melting point of ginkgolic acid is about 136 °C and the boiling point is about 500 °C. At 200 °C, the carboxyl group on the phenolic acid benzene ring will undergo a decarboxylation reaction to release CO2, which can be separated using the temperature gradient method. Therefore, according to physical and chemical property research, in the processing of ginkgo products, methods such as “hot air cooking”, “ultrasonic-assisted extraction of ginkgo phenolic acid with resin adsorption” and “compatibility of Chinese medicinal herbs” are often used to remove phenolic acids to achieve the purpose of detoxification. Chen et al. [18] latest investigaciónresults show that the laccase immobilized on a new tipoof electrospun nanofiber felt can catalyze the degradation of ginkgo phenolic acid. However, the above-mentioned methods for dephenolic acid treatment have disadvantages such as high cost and difficulty of operation, and are not suitable for large-scale detoxification.
1.2 actividad biológica de ginkgolides
Los ginkgolidas tienen efectos antibacterianos, insectici, alergénicos, citotóxicos y anticancerosos. Sus diversas actividades biológicas pueden ser explotadas en la producción agrícola, la salud y otros campos.
1.2.1 efecto antibacteriano
El ácido Ginkgo es un ácido 6-alquilsalicílico, que tiene una amplia gama de propiedades antibacterianas. Tiene un efecto inhibitorio sobre Bacillus subtilis, Escherichia coli, Staphylococcus aureus, Shigella dysenteriae, Pseudomonas aeruginosa, y una variedad de bacterias gramnegativas y grampositivas [19-20]. Su ácido extractante tiene un efecto inhibitsobre el hongo de la vaina del arroz, el hongo de la marchitadura del tomate, el hongo antracnode de manzana, el hongo de la mancha de la hoja de maíz y el hongo del moho rojo, y su efecto antibacteriano es comparable al de algunos medicamentos antifún[21]. Xu Lichun et al. [22] mostraron que el ácido ginkgoico 0,1% (15:1) tuvo una tasa efectiva de 92% en la inhibición de hongos, mientras que el clotrimazol 0,5% tuvo solo 68% de eficacia. Muroi et al. [23] mostraron que el ácido ginkgoico tuvo un efecto sinérgico con los medicamentos antibacterianos estándar para matar al Staphylococcus aureus resistente a la meticilina, y la actividad bactericida de la combinación fue por lo menos 100 veces más alta que la del medicamento único en 48 horas.
1.2.2 efecto insectici.
Ginkgolide acid has been shown to have a significant killing effect on aphids, grubs, cabbage moths, spider mites, mulberry ticks, rice borer and other chewing mouthparts insects [20]. In a test to controlaphids, Shi Qitian [24] found that the killing effect of ginkgolide acid extract was comparable to that of the pesticide imidacloprid. Deng Yecheng et al. [25] used different polarities of exocarp extracts in contact toxicity tests and found that they had a strong killing effect on the brown planthopper, peach aphid, red spider and cabbage butterfly larvae.

1.2.3 efectos alérgicos
In 1934, Hill et al. [26] reported that an active substance in ginkgo has a strong erosive effect on the skin. In 1969, Gellermen isolated lacquer phenolic acids from cashew nuts and ginkgo seeds, respectively, and pointed out that they have a strong sensitizing effect on the skin [5]. Cheng Liang et al. [27] reported that ginkgolic acid (C15:1) is metabolized to ginkgolide, which is further oxidized to form catechol, causing an allergic reaction. Vincieri et al. [28] showed that ginkgolic acid can inhibit the activity of various dehydrogenases in glucose metabolism. Ahlemeyer et al. [29] found that ginkgo acid has a competitive inhibitory effect on glycerol-3-phosphate dehydrogenase. Some scholars speculate that ginkgolic acid has a bipolar nature (hydrophilic and lipophilic) and can inhibit the activity of enzymes related to the body or organs, thereporaffecting metabolism and causing allergies [30].
1.2.4 citotoxicidad
El Ginkgolide tiene dos grupos hidrófilo y lipofílico, que pueden unirse a la membrana celular a través de la membrana y causar la muerte celular. Al-Yahya et al. [31] usaron extracto de ginkgo que contenía ácido de ginkgo para realizar una prueba de toxicidad en ratas macho y los resultados mostraron que el extracto puede causar la pérdida de cromosomas como las células germinativas, afectando la función reproductiva normal de las ratas. Ahlemeyer et al. [29] encontraron que el ácido ginkgolide tiene neurotoxicidad y puede llevar a la muerte de las células del neuroblastoma de pollo. En los últimos años, los investigadores han realizado estudios separados sobre la toxicidad de varios ácidos ginkgo. Jiang et al. [32] encontraron que el ácido ginkgo (C15:1) puede causar estrés oxidativo y daño a las células del hígado de rata al inducir trastornos metabólicos de purina. Yao et al. [33] encontraron que la toxicidad del ácido ginkgo heptadecilideno (C17:1) para las células HepG2 es directamente proporcional al tiempo y la dosis, y aumenta la citotoxicidad mediando el metabolismo de CYP1A y CYP3A. Los estudios han demostrado que entre los ginkgolidos, el ácido ginkgolic (C13:0), el ácido ginkgolic (C15:1) y el ácido heptadecilideno ginkgo (C17:1) son más tóxicos, y otros ácidos fenópueden actuar en combinación con los tres ácidos ginkgo para aumentar la citotoxicidad.
1.2.5 efecto contra el cáncer
Los ginkgolidos tienen citotoxicidad y pueden desempeñar una función contra el cáncer. Qiao et al. [34] encontraron que el ácido ginkgo puede inducir la activación de la proteína quinasa activpor monofosfato de adenosina (AMPK) para inhibir la proliferación y la migración. Liang et al. [35] encontraron que el ácido ginkgo puede inhibir el crecimiento de células de cáncer gástrico al inhibir la vía de señalización de STAT3/JAK2 regulada por ros. Liu et al. [36] mostraron que el ácido ginkgo puede bloquear la transición de las células de cáncer de El colondesde la fase G0/G1 de la división celular, lo que lleva a la muerte de las células cancerosas. Experimentos celulares In vitro han demostrado que el ácido ginkgo puede inhibir la proliferación y migración de células cancerosas y activar enzimas relacionadas para promover la apoptosis. Y puede convertirse en un medicamento adyuvcontra el cáncer para el tratamiento de tumores en el futuro.
2 Ginkgolide biosíntesis
In the 1970s, Gellerman from the University of Minnesota in the United States used the 14C labeling method to conduct a preliminary exploration of the ginkgolide acid synthesis pathway. In the 1990s, Walters et al. [37] used gas-liquid chromatography (GLC trapping) to analyze labeled monomethyl esters extracted from liquid chromatography (HPLC), and determined the specific synthetic steps of Urushiol (2-hidroxi6-alk (en) ácido il-benzoico) en geranio. Singhal [38] y Narnoliya et al. [39] investigaron además los tipos y funciones de las enzimas clave en la síntesis de Urushiol.
2.1 Ginkgolide biosynthetic pathway
Gellerman et al. [6-7] creen que el anillo aromático y el grupo alquilo/alkenilo de cadena larga del ginkgolide se sintetizpaso a paso, de acuerdo con la inferexperimental, se divide en tres partes: − malonil-coa y acetil-CoA forman palmitoil-coa y oleoil-coa libres a través de la síntesis de ácidos grasos; − acil-coa de cadena larga es sintetizpara formar ácido ginkgólico a través de la síntesis de poliquetida; − el ácido ginkgólico pierde el grupo carboxilo del anillo de benceny se oxiy reduce a sustancias como el ginkgol.
Pelargonium hortorum es una planta perteneciente a la familia Geraniaceae. Sus tricomas sólo secretan ácido siquímico (un homódel ácido ginkgoico), por lo que es la mejor especie para estudiar la vía de síntesis de ácido siquímico. El geranisilvestre segregácido shikimic con una cadena lateral satur, mientras que los tipos resistentes a los insectos secretan ácido shikimic con una cadena lateral monoinsatur(C15:1 y C17:1). Estudios han encontrado que el ácido urushiol insaturen los geranios es idéntico en estructura molecular a los dos ácidos ginkgolic (ácido ginkgolic (C15:1) y ácido ginkgolic (C17:1)) excepto por la diferencia en la posición del doble enlace. Hesk et al. [12] compararon los genes diferenciales y metabolide geranios de tipo silvestre y resistentes a insectos, y revelaron el mecanismo molecular de la síntesis de urushiol. Los investigadores utilizaron la tecnología RNA-seq para construir una base de datos de transcriptode cDNA de gerani, e identificaron los genes clave para la síntesis de ser el gen Polyketide Synthases Ⅲ (PKS Ⅲ) y el gen Stearyl-ACP desaturasa (SAD) a través de la comparación de anotación génica y el análisis de expresión diferencial. La vía reguladora de la síntesis de ginkgoda se explica usando el ácido ginkgolic (15:1) y el ácido inkgolic heptadecylideneg(17:1) como ejemplos.

2.1.1 síntesis de la cadena lateral de alquilo
La síntesis de ginkgolides se basa primero en la síntesis de ácido palmitoleico y ácido oleico, es decir, la síntesis de la cadena lateral de alquil. la fermentación de la sacarosa almacenen fosfoenolpiruvato, el cambio alostérico de piruvato quinasa (piruvato quinasa) para formar piruvato del citoplasma en el plastid, y la catálisis de piruvato deshidrogenasa (piruvato deshidrogenasa, PDH) para formar acetil-CoA proporciona la molécula 2C inicial para los ácidos grasos. La acetil-CoA es catalizada por acetil-CoA carboxilasa (Ace- til-coa carboxilasa, ACC) para formar malonil-coa. La transacilasa (TA) reempla la molécula CoA con una proteína transportacilo (ACP) para formar malonil-acp. Malonil-acp pierde su grupo carboxilo para convertirse en acetil-acp, y se condensa en un ciclo por la -cetoacil-acp sintasa III(KAS III) para formar el material de partida 4C acil-acp.
El acil-acp 4C es repetidamente condensado por la -cetoacil-acp sintasa I (KAS I) para formar palmitoil-acp (C16:0 ACP), que luego es deshidrogenado por la -9-estestaroil-acp desaturasa (SAD) para formar palmitoléico-acp (− 9 C16:1 ACP). SAD) es deshidrogenado a ácido palmitoleico -ACP (− 9 C16:1 ACP), y luego catalizado por la cetoacil-sintasa II (− -cetoacil-acp sintasa -, KAS -) para formar ácido oleico -ACP (− 11 C18:1 ACP). Palmitoil-acp y oleooacp en los plastidos son respectivamente desacetilpor tioesterasa A (TE/FatA) y tioesterasa B (TE/FatB) para formar ácidos grasos insaturados libres [40]. Finalmente, los ácidos grasos libres se convierten en palmitoleil-coa (− 9 C16:1CoA) y oleoil-coa (− 11 C18:1CoA) por la acil-coa sintasa (ACS) en la membrana externa del plastid, y se transfial citoplasma para convertirse en los dos precursores importantes de los ácidos ginkgolic.
Sin embargo, las vías de síntesis de ácidos grasos del ácido ginkgólico y geranilgeranilo son diferentes. Los precursores para la síntesis de ácido ginkgolic (C15:1) y ácido inkolic heptadecylideneg(C17:1) son ácido palmitoleico (− 9 C16:1) y ácido oleico (− 11 C18:1), mientras que los precursores para la síntesis de las 2 cadenas laterales monoenilo de ácido oleico son ácido palmitoleico (− 11 C16 − 1) y ácido oleico (− 13 C18 − 1). Los ácidos grasos comunes − -7 (ácido palmitoleico (− 9 C16 − 1) y ácido oleico (− 11 C18 − 1)) pueden formarse en muchas plantas silvestres y algas a partir de palmitoil-acp (C16 − 0 ACP) por desatur, policetona y otras reacciones. Schultz et al. [41] encontraron que un nuevo tipo de geranilo ACP desaturasa en geranideshidrogeniza ácido mirístico -ACP (C14:0 ACP) para formar ácido mirístico -ACP (− 9 C14:1), y luego se someten a policetida y otras reacciones para formar dos ácidos grasos monoinsaturados (ácido palmitoleico (− 11 C16:1) y ácido oleico (− 13 C18:1)). Por lo tanto, la vía sintética de los ácidos grasos precursores del ácido ginkgólico es más fácil de explorar que la del ácido pelargonólico en los geranios.
Singhal [38] identificó y verificla expresión de genes relacionados con la síntesis de ácidos grasos monoinsaturados (ácido palmitoleico y ácido oleico) en geranio. Los resultados mostraron que cuando la expresión génica de las proteínas portadoras de acilo (ACPs), ketoacil sintasa (KASs) y tioesterasas (TEs) en el tejido era alta, el contenido de ácidos grasos y ácido ursólico también era alto. La proteína transportacil (ACP) es un transportador intermedio conservado que es central para el proceso de síntesis de ácidos grasos. Trabaja con la acil-acp desaturasa (AAD) para desaturla la cadena acilo, cambiando la relación de ácidos grasos saturados e insaturados. También puede actuar como una enzima limitante de la velocidad junto con la cetoacil-acp sintasa (KAS) para regular la tasa de síntesis de ácidos fenó.
2.1.2 síntesis del anillo de fitilbenceno
La síntesis del anillo de fitilbenceno es un paso clave en la formación de ácidos fenóa partir de ácidos grasos superiores. La vía de síntesis se muestra en la figura 4. Tomando ácido gammacerolico (C15:1) como ejemplo, en primer lugar, palmitoilo (− 9 C16:1) de la vía de los ácidos grasos utiliza malonil-coa como sustry bajo la acción de la policetida Syn- tasa - (PKS -), cuatro átomos de carbono se añaden al extremo acilo a través de una reacción de condensde dos pasos; En segundo lugar, el grupo cetona en la posición C3 se reduce por la cetona reductasa (PKS- cetoacil-coa reductasa, KR) para formar un grupo hidroxilo, y un doble enlace se forma por la deshidratasa (PKS-dehydratase, DH) elimina una molécula de agua para formar un doble enlace; En tercer lugar, después de la condensación y la polimerización, se añaden dos átomos de carbono más al extremo acilo. En este momento, el ion hidrógeno en la posición C2 se acerca más al grupo cetona en la posición C7 para mantener la estabilidad de la estructura intermedia del 4,15-dieno tripéptido; Cuarto, asegurando que el grupo cetona en C1 no descarboxilato, la ciclas(pks-ciclas) cataliza la ciclización del ion hidrógeno en C2 con el grupo cetona en C7, similar a una condensaldólica, y un doble enlace se forma bajo la acción de la deshidratasa (pks-dehidratasa); Quinto, la enoil-reductasa (PKS-enoyl reductasa, ER) cataliza la formación de un doble enlace y la aromatización del grupo cetona en el anillo de carbono hexagonal. Junto con el grupo carboxilo C1 forman la estructura del ácido benzoico; Finalmente, la cadena lateral monoinsaturse forma para producir ácido ursólico (C15:1) [37,39].
Planta tipo IIIpoliketide sintasa (PKS III) es la enzima limitante para la síntesis de lípidos fenó(alquilfenoles, alquilres- cyls, urushiols, alquilcatechols, etc.) [42]. La sintasa de Chalcone (CHS) y la sintasa de (en millones de ecus)(STS) son dos de las superfamilias más representativas. STS) son dos de las superfamilias más representativas. Pueden catalizar la condensación y ciclación de las cadenas acilo en las posiciones C1 y C6 (condensde Claisen) y en las posiciones C2 y C7 (condensaldol), respectivamente, para formar sustancias fenólicas. Sin embargo, los ácidos urónicos pueden catalizar la condensdel ion hidrógeno en la posición C2 con el grupo cetona en la posición C7 mientras retienen el grupo carboxilo en la posición C1 para formar ácido benzoico. Esta reacción de cicde policetida que retiene el grupo carboxilo del anillo de bencenes es relativamente rara en las plantas. Por lo tanto, la investigación adicional sobre policetida sintasa tipo III (PKS III), ciclas(pks-ciclas) y cetoacil-coa reductasa (pks-cetoacil-coa reductasa, KR) puede revelar aún más el mecanismo de la síntesis del ácido ginkgolic, y el contenido de ácidos fenóen los tejidos de ginkgo puede ser controlado mediante la combinación de métodos físicos y químicos o biotecnológicos.
2.2 genes clave de enzimas para la síntesis de ácidos fenó.
At present, the main reports on the research of key enzyme genes for phenolic acid synthesis come from urushiol, while there are few reports on ginkgolides. La vía de síntesis de ácidos fenóse divide en 2 partes: síntesis de ácidos grasos y síntesis de anillos aromáticos. Entre estos, la proteína transportacil (ACP), la estaroil desaturasa (SAD), la cetoacil-acp sintasa (KASs), la policetida sintasa tipo III (PKS III) y la ciclas(pks-ciclas) son enzimas clave que determinan la tasa y proporción de contenido de la síntesis de urushiol.
2.2.1 proteína transportadora de acilo (ACP)
La proteína transportadora de acilo (ACP) pertenece a la gran familia de proteínas transportadoras. Como una proteína mixta, se puede asociar con varios complejos proteína-enzima para transferir cadenas acilo de un sitio central de la enzima a otro. También actúa como un cofactor para la estaroil-acp desaturasa (SAD) y acil-acp hidrolasa (AAH), y juega un papel importante en la síntesis de ácidos grasos (FAS) y la síntesis de policetida (PKS) vías.
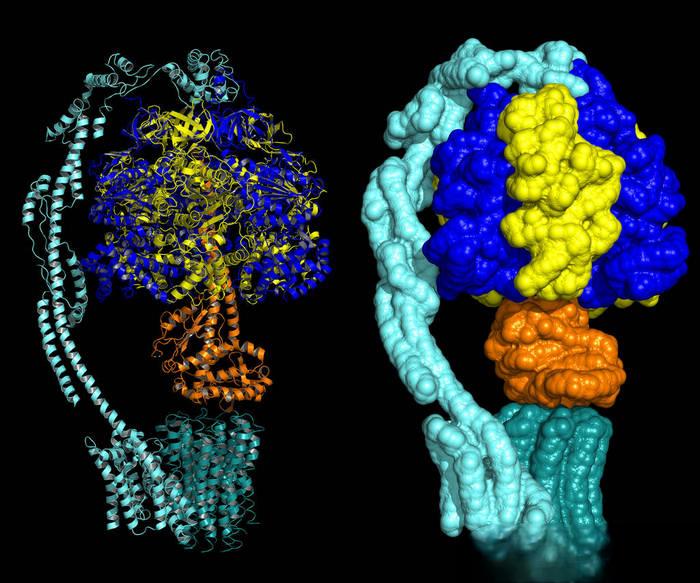
Li Mengjun et al. [43] analizaron la estructura de los genes de las proteínas portadoras de acilo en 17 especies, incluyendo Arabidopsis thaliana, Clycine max, Oryza Sativa.y Zea mays, y las clasificaron en cinco categorías. Entre ellos, la familia de genes ACP de tipo plasmedio (la región codificante consta de 4 exones y 3 intrones) y la familia de genes ACP de tipo mitocon(la región codificante consta de 2 exones y 1 intron) representan la mayor proporción del total. Ambos tienen un sitio serino muy conservado que puede unirse al 4' grupo cofactor -fosfofosfoteína aducto, y activar el holo-ACP para funcionar. La estructura tercide la familia de proteínas ACP es consistente y consiste de cuatro héhéconservadas. Tres de las hé− (I, II, IV) son paralelas entre sí, mientras que la hé− (III) es perpendicular al centro de la hé, formando una cavidad estructural hidrofóbica que proporciona una estructura hidrofóbica protectora para varias cadenas acilo [44].
La héα puede interactuar con la cetoacil-acp sinthase Ⅱ (-cetoacil-acp sinthase Ⅱ, KAS β) para extender aún más la cadena acilo, y es conocida como la héde reconocimiento. Singhal [38] realizó la secuencidel transcriptoma en geranios y examinó dos secuencias completas de cDNA de la proteína ACP (Pxh1 y Pxh2) relacionados con la síntesis de ácido urushiol. La verificación de la expresión génica y el análisis filogenético mostraron que los genes Pxh1 y Pxh2 estaban altamente expresados en el tejido tricomo de geranio, y son altamente homólogos al gen de la proteína de biosíntesis ACP del cilantro (Coriandrum sativum), que cataliza la desaturde de ácidos grasos en la vía del ácido urónico.
Cetoacil-acp sintasa (KASs)
Bajo la acción del complejo de ácidos grasos sintasa (FAS), malonil-acp se utiliza como sustrpara formar los precursores del ácido ginkgólico, ácido palmitoleico (− 9 C16:1) y ácido oleico (− 11 C18:1), a través de múltiples ciclos de condens. El complejo de ácidos grasos sintasa se compone de tres cetoacil-acp sintasa (KASs), que pertenecen a la superfamilia de cond-enzimas. Todas son lipoproteínas hidrofóbicque contienen el dominio estructural conservado KAS y ningún péptido señal. KAS III cataliza la polimeride malonil-coa y acetil-CoA para formar la cadena acilo inicial (3-cetobutiril-acp); KAS I cataliza la polimeride la cadena acilo y malonil-acp para formar ácidos grasos con 6C-16C; Y KAS II cataliza la condensde malonil-acp y ácido palmítico para formar ácidos grasos 18C.

En plantas como la perilla [45] y el algodón de tierras altas [46], KAS II es una proteína ligeramente ácida no secretada con una longitud de aminoácidos de aproximadamente 500 AA. Determina la relación de ácidos grasos C16:C18 y puede regular la resistencia al frío de la planta. Los investigadores han obtenido siete genes de cetoacil-acp sintasa (KASs) del transcriptoma de Pelargonium xanthium, de los cuales PxKASⅠa, PxKASⅠb y PxKASⅠ C tienen una expresión alta y estable en el tejido tricoma de Pelargonium xanthium, mientras que la expresión génica en otros tejidos es baja. El tratamiento posterior de tricomas con gradide temperatura (18, 23 y 28 °C) mostró que la expresión de los tres genes disminuyó con el aumento de la temperatura, y se correlacionpositivamente con el contenido de ácidos grasos (ácido palmitoleico (− 11 C16:1) y ácido oleico (− 13 C18:1)) y urushiol, o involucrados en la vía de síntesis de urushiol. El análisis evolutivo muestra que la familia de genes KAS del geranies altamente homóloga a los genes ketoacil sintasa (KAS) de Arabidopsis thailana y Glycine Max, y el mecanismo catalítico relacionado es relativamente claro. Sin embargo, ha habido pocos estudios moleculares sobre el KAS de la ginkgolide cetoacil-acp sintasa (KAS). Cómo el precursor ácido palmitoleico (− 9 C16:1) y ácido oleico (− 11 C18:1) del ácido ginkgo (C15:1) y el ácido heptadecenoico (C17:1) son regulados por la familia ginkgo cetoacil-acp sinproporción como importantes ácidos grasos monoenriquinsaturados permanece por ser explorado en profundidad.
Desaturasa estaroil-acp (SAD)
La estaroil-acp desaturasa (SAD) es la única familia conocida de desaturasas solubles en plantas, que regula la proporción de ácidos grasos saturados a insaturados. Entre ellas, la estestaroil-acp desaturasa es la más estudien las plantas. Cataliza la deshidrogenación de las posiciones C9 y C10 de la cadena acilo para formar el primer doble enlace. La proteína SAD es un homodímero compuesto por un dominio conservado perteneciente a la familia de las desaturasas acil-acp y un dominio conservado perteneciente a la familia de las ferritinas. Las cuatro héen en la región conservsad forman una estructura de haz de cuatro hé, que oculta un centro catalítico de Fe-O-Fe de dos cústeres de hierro simétrico. Juntos, forman el centro activo de la enzima para la deshidrogenación de la cadena acilo [47]. La estructura cristalina de la proteína muestra que la enzima SAD tiene una profunda ranura que se extiende desde la superficie molecular hasta el interior, que puede acomodar la cadena de acilo 18C y unirse al centro ferroen la parte inferior de la ranura para sufrir reacciones redox. Esta estructura de ranura también puede acomodar las cadenas de acilo 16C y 14C para reaccionar, pero la tasa de recambio catalítico es baja [48].
Schultz et al. [41] examinaron una nueva acil-acp desaturasa de una biblioteca de cDNA de gerani. El alinede la secuencia géreveló un alto grado de homología con el gen de ricino stearoil-acp desaturasa (SAD). Los resultados de la transformación genética y la verificación usando Escherichia coli (E. coli) mostraron que el nuevo gen puede catalizar la deshidrogenación del ácido mirístico -ACP (C14:0) para formar ácido mirístico -ACP (− 9 C14:1), por lo que se le llama gen mirístico acido-acp desaturasa (MAD, − 9 14:0-ACP desaturasa). La detección de la expresión génica Singhal [38] y los resultados de la validación de la transformación genética del tabaco (Nicotiana tabacum) muestran que tetradecil-acp (− 9 C14:1), el producto catalizado por la ácido mirístic -ACP desaturasa (MAD), es un precursor clave de palmitoleica-acp (− 11 C16:1) y oleica-acp (− 13 C18:1). La actividad de la miristoil-acp desaturasa (MAD, − 9 14 − 0- ACP desaturasa) determina el contenido de palmitoil-acp (− 11 C16 − 1) y oleoil-acp (− 13 C18 − 1) mediante la detección de la actividad enzim, contenido de ácidos grasos y contenido de ácidos fenó, que a su vez regula el contenido de las dos cadenas laterales monoenilo, ácido oleico (C22:1 y C24:1). Además, Singhal [38] estableció un gradiente de temperatura (18, 23 y 28 °C) para investigar los cambios en la expresión de genes de enzimas relacionadas en el tejido del geranium trichome, y encontró que los niveles de expresión del gen de la desaturasa del ácido myristic (MAD, − 9 14 − 0- ACP desaturasa) y el gen stearoil-acp desaturasa (SAD, − 9 18 Δ La expresión de 0-ACP desaturasa) disminuyó con el aumento de la temperatura.
Wang et al. [49] cloned a stearoyl-ACP desaturase gene (SAD, Δ9 18:0-ACP desaturase) from Ginkgo biloba leaf cDNA and subjected Ginkgo biloba leaves to temperature stress (4, 15 and 45 °C). The results showed that the gene Expresión expresiónwas high at low temperatures (4 °C) and room temperature (15 °C), while the gene expression at high temperatures (45 ℃) was several times lower than that of the control group. Subsequently, Liu Xinliang et al. [50] showed that the GbSAD gene encodes a peptide chain with a chain length of 412 aa and a molecular weight of 47 kDa. Cluster analysis showed a high degree of similarity with the stearoyl-ACP desaturase (SAD) amino acid sequences of other gymnosperms. Exogenous hormone experiments showed that the expression of the GbSAD gene was not reguladoby abscisic acid (ABA), methyl jasmonate (MeJA) or ethylene (ETH), but salicylic acid (SA) activated gene expression, with the highest expression value being 9.7 times that of the control group, indicating that SA may be involvedin the regulation of the fatty acid synthesis pathway.
Pelargonium graveolens y Ginkgo biloba contienen el único ácido mirístico-acp desaturasa (MAD, − 9 14 − 0-ACP desaturasa) y ácido esteári-acp desaturasa (GbSAD, − 9 18 − 0-ACP desaturasa), respectivamente. Ambas enzimas son sensibles a la temperatura y altamente activas a bajas temperaturas. Ambas enzimas son las únicas desaturasas soluen agua en las plantas y tienen un alto grado de similitud en términos de su estructura funcional. Por lo tanto, la verificación de la función homóde la desaturasa de ginkgo stearoil-acp (GbSAD, − 9 18:0-ACP desaturasa) aclarará aún más el mecanismo de la síntesis de ácido de ginkgolida.

2.2.4 poliketide sintasa de tipo III (PKS III)
Las sintasas de policetida se dividen en tres categorías: − PKS I, conocido como PKS modular, está compuesto de varios polipéptidos multifuncionales, cada uno de los cuales lleva un dominio catalítico único, no reutiliz. PKS II, también conocido como PKS iterativo o PKS aromático, es un sistema iterativo de un complejo multienzimque utiliza un conjunto de dominios reutilizpara catalizar la formación de estructuras policetónicas de fenol múltiples veces durante pasos de reacción repetidos. − PKS III, conocida como la enzima tipo sintasa de chalcone, es completamente diferente de los dos primeros tipos de familias de enzimas PKS. Puede reutilizar proteínas bifuncionales homólogas, no depende de la activación de ACP y su sitio activo 4' -fosfofosfoteína sulfur, y no necesita activar el sustracil-coa a través de ACP para reaccionar directamente con acil-coa. Aunque los mecanismos estructurales de los diferentes tipos de PKS son diferentes, todos ellos utilizan el dominio de la cetosintasa (KS) o subunidad para catalizar la formación de enlaces C-C, que descarboxilato y condense acil-coa para extender la cadena de carbono.
La familia PKS III es muy diversa. La sintasa de chalcona (CHS) y la sintasa de stilbene (STS) son las dos familias más antiguas descubiertas y más representativas. Sus secuencias de aminoácidos son 60% a 75% similares [42]. La familia de la sintasa chalcone (CHS) se encuentra ampliamente en las plantas. Es una proteína homodimérica con un peso molecular de 40-45 kDa. Usando un centro activo altamente conservado (una combinación de cyhis-asn), cataliza la elongde la cadena de carbono de la cumarina CoA usando tres sustrde piruvatocoa para formar una estructura de anillo intermedio de tetrapéptido [42,51-52]. El ion hidrógeno C6 del anillo intermedio tetrapéptido sufre una reacción de condensde Claisen con el grupo C1 cetona para formar un anillo de carbono hexa miembros, que luego se aromatipara formar una difenilcetona, también conocida como chalcon (figura 5). Chalcone es un precursor importante para la síntesis de flavonoides. La enzima stilbeno sintasa (STS) se ha descrito en plantas y microorganismos (por ejemplo, Streptomyces, levadura y bacterias). Tiene un peso molecular de aproximadamente 43 kDa, es un dímero que consta de 2 subunidades, y tiene una proteína con un dominio específico conservado IPNS(F) AGAIAGN, que es altamente homóloga a la chalcone sintasa (CHS) [53].
La enzima STS utiliza coumaroil CoA como sustrpara formar una estructura de anillo intermedio tetrapéptido. El grupo C7 cetona del anillo intermedio tetrapéptido sufre una reacción de condensación aldólica con el ion hidrógeno C2 para formar un anillo de carbono de seis miembros, y luego aromatipara formar la fitoalexin resveratrol glucósido [54] (figura 5). Singhal [38] identificó una cetoacil CoA sintasa tipo 2 (KCS2, ceto-acil CoA sintasa 2) en gerani(Pelargonium hortorum), su estructura espacial tercies similar a la de policetida sintasa tipo III (PKS III), Y se especula que está involucrado en la reacción de condensación por ciclización en la vía de síntesis del urushiol. La cetoacil CoA sintasa (KCS) es una enzima limitante de la velocidad que cataliza la primera reacción de condensen la síntesis de ácidos grasos de cadena muy larga (VLCFAs). La investigación sobre su familia génica se ha centrado principalmente en la planta modelo Arabidopsis thaliana, y hay pocos informes de investigación en otras plantas. Costaglioli et al. [55] clasificaron los 21 miembros del gen KCS en Arabidopsis en cuatro subgrupos (FAE1, KCS1, FDHy CER6) con base en la homología génica y el análisis de la evolución genética. Entre ellos, el gen FAE1 fue el primer gen de la familia KCS clonado por James et al. [56] usando el método de marcado transposon. La secuencia de aminoácidos de FAE1 es altamente homóa otras sintasa policetida (chalcone sintasa (CHS), squalene sintasa (STS), y tipo III cetoacil-acp sintasa (KAS III)).
La cetol-acil CoA sintasa (KCS) de diferentes especies tiene diferentes especificidades de sustr. Ginkgolide A pertenece A la Sustancias ácidas de laca Y su poliketide sintasa de tipo específico de camino III (PKS III) es similar en términos de su estructura funcional a geranium's tipo 2 ceto-acil CoA sintasa (ceto-acil CoA sintasa 2). Además, la policetida sintasa de la ruta del ácido urushiol y la acitransferasa (STS) reconocen el grupo C7 cetona en el anillo intermedio tetrapéptido y el ión de hidrógeno C2 para someterse a una reacción de condensación aldólica para formar un anillo de carbono hexa miembros. La diferencia es que la aciltransferasa (STS) sufre una reacción de descarboxilación durante la reacción de ciclde condensaldólica, que oxiel grupo cetona en la posición C1 para liberar dióxido de carbono, sin embargo, durante la ciclación de policetida del ácido lactónico, el grupo C1 cetona se retiene, yla estructura del ácido benzoico se forma por la sustitución de CoA con un ion hidrógeno (H+). El mecanismo catalítico actual aún no está claro y requiere más investigación.
2.2.5 policetida ciclas(pks-ciclas)
El ácido 2,4-dihidroxi6-pentilbenzoico (ácido olivetólico), también conocido como ácido olivetólico, es un importante precursor para la síntesis de cannabinoides. Gagne et al. [57] encontraron que el hexanoil-coa es catalizado por la PKS III (TKS) de cannabis para sintetizar una estructura de anillo intermedio tetrapéptido que contiene 12 carbonos. Si la enzima TKS continúa catalizando, la cadena acilo se condensa y se cicliza en las posiciones C2 y C7, liberando CO2 para formar 3,5-dihidroxipentilbenceno (Olivetol); Mientras que la reacción de condensy ciclación catalizada por la ciclaspks (ácido olivetolico cy- classe, OAC) cataliza una reacción de condensque retiene el grupo C1 carboxilo para producir ácido 2,4-dihidroxi6-pentilbenzoico (ácido olivetolico). El análisis de función proteica muestra que la enzima OAC contiene una topoúnica β-α- - - - - - - - - - - - - y puede catalizar la cicdel grupo acilo en las posiciones C2 y C7 y retener el grupo carboxilo.
OAC es una nueva proteína funcional que contiene un dominio dimérico − + − barril (proteína dimérica − + − barril, DABB), que se encuentra principalmente en bacterias, hongos y plantas. Con la excepción de la ciclascsoac del ácido canabidióde Cannabissativa, las proteínas similares a la dabb vegetal son principalmente de la familia de las proteínas termoestables (HS) y son muy similares en estructura a las ciclasde policetida de las especies de Streptomyces [58]. La proteína DABB es una proteína pequeña (12 kDa, 101 AA) que se encuentra en el citoplasma con la PKS III, juega un papel similar a la chaperona al guiar el plegdel producto intermedio tetrapéptido, y finalmente forma una sustancia que contiene una estructura de ácido benzoico. La investigación de Gagne et al. [51] retuvo el grupo C1 cetona para la ciclación de policetida de la síntesis de ácido lacónico, proporcionando nuevas referencias e ideas para el proceso catalítico de la formación de ácido benzoico.
3 perspectivas
En la década de 1960, los ginkgolifueron identificados como una de las sustancias activas en la capa exterior de la semilla de ginkgo. Con la popularización de la tecnología de cromatografía líquida de alto rendimiento de espectrometría de masas (HPLC-MS/MS) y la mejora de la precisión de detección de RMN (tecnología de resonancia magnética nuclear), ahora es posible aislar e identificar los cinco ácidos de ginkgo comunes y cuatro ginkgolidos de tejidos tales como hojas de ginkgo y frutos. Los ginkgolidos son lacas y tienen propiedades polares únicas (hidrofóbicas e hidrofílicas), que han llevado a su uso en muchos campos como la medicina, productos químicos, belleza y control de plagas. En particular, el ácido ginkgólico (C15:1) se ha demostrado por Fukuda et al. [59] para prevenir la acilación de pequeñas proteínas modificadoras relacionadas con la ubiquitina (SUMO) para regular las funciones celulares relacionadas. Se considera un medicamento potencial para el tratamiento del cáncer y enfermedades neurológicas y es digno de investigación y desarrollo.
Además del ginkgo, los ácidos urushiol también han sido aislados e identificados en cultivos comerciales como el árbol de Marañón (C. equatorialis), zumaque, pistachos y geranios. Schultz et al. [60] llevaron a cabo experimentos sobre la síntesis del ácido urushiol. Los resultados mostraron que el ácido cítrico marcado con 14c, propionil-coa, oleoil-coa, ácido acético, ácido mirístico y ácido palmítico fueron incubcon células de tricomas de Pelargonium graveolens. Solo la oleoil-coa (C18:1) se encontró involucrada en la síntesis de Urushiol como una fuente de carbono eficaz, mientras que las otras sustancias tendían a sintetizar triacilglicerol para formar lípidos de almacenamiento. Por lo tanto, la palmitoleoil-coa (C16:1) y la oleoil-coa (C18:1) se han identificado como precursores importantes para el estudio de la síntesis de ácido lacosana. Sin embargo, la ginkgolide, como una fitoalexina única al ginkgo, tiene una vía de síntesis y regulación molecular evolutiva especial y conservada. En la actualidad, la investigación sobre la regulación de la síntesis de ginkgolida se centra principalmente en el transcriptolipídico y el análisis metabolómico, mientras que hay pocos informes sobre la exploración del mecanismo de síntesis de poliquetida y la clonación de genes relacionados, por lo que se necesita más investigación.
Los factores de transcripción MYB y WRKY pueden regular la expresión de los miembros de la poliketide sintasa de tipo III (PKS III) de la familia, afectando los cambios en el contenido de metabolisecundarios con efectos de resistencia. La enzima limitante clave en la síntesis de ácido de laca es una policetida sintasa de tipo III (PKS III) que es altamente homóa la cetoacil CoA sintasa (KCS). Eckermann et al. [61] encontraron que el herbimetazaclorpuede inactivar la enzima limitante de la tasa (ketolacton CoA sintasa (KCS)) en la síntesis de ácidos grasos de cadena muy larga (VLFAS), así como la chalcone sintasa (CHS) y squalene sintasa (STS) de la poliketida sintasa de la familia III. Cloroacetamida metazacaclor puede unirse a la cisteína en el sitio clave de la enzima relevante, evitando que la reacción de condensse produzca normalmente. En el futuro, la sustancia química será verificada utilizando una línea celular de suspensión de ginkgo para determinar si también puede inactivar la policetida sintasa de tipo III (PKS III) que sinteel ácido lacónico. Esto proporcionará una mayor comprensión de la función catalítica y el mecanismo regulador de la policetida sintasa de tipo III (PKS III) en la síntesis de ácido lacónico. La progresiva elucide estos mecanismos reguladores proporcionará orientación teórica y práctica para el cultivo de líneas celulares con bajo o alto rendimiento de ácidos fenólicos.
referencias
[1] Ma Jing, Huo Xiaoqian, Chen Qian, et al. Investigación sobre la detección potencial de coronavirus antinovemedicina China basada en Mpro y PLP [J]. Chinese Journal of Traditional Chinese Medicine, 2020, 45(6): 1219-1224.
[2] Wang Sujuan, Kang An, Di Liuqing, et al. Avances en la investigación farmacocinética de los principales principios activos del extracto de Ginkgo biloba [J]. Chinese Herbal Medicine, 2013, 44 (5) : 626-631.
[3]Zhang Xinhui, Guo Qirong, Wang Guibin, et al. Progreso de la investigación del ginkgo biloba seed Coat [J]. Heilongjiang Agricultural Science, 2018(11) : 156-160.
[4]ITOKAWA H,TOTSUKA N,NAKAHARA K,et antitumoral Principios de Ginkgo biloba L.[J]. Química y farmacéutica Boletín,1987,35 (7) : 3016-3020.
[5]GELLERMAN JL,SCHLENKH. Preparación de 14 ácidos grasos y anacárdicos marcados con la marca C a partir de Ginkgo biloba[J]. Lípidos,1969,4 (6) : 484-487.
[6]GELLERMAN JL,ANDERSON W H,SCHLENK H. Biosíntesis de ácidos anacárdicos a partir de acede en Ginkgo biloba[J].lipi, 1974,9(9) : 722-725.
[7]GELLERMAN J L,ANDERSON W H,SCHLENK H. Síntesis de anacardic Ácidos en las semillas de Ginkgo biloba[J]. Biochimica et biophysica Acta,1976, 431 (1) : 16-21.
[8] Wang J, Yu B, Liu X, et al. Aislamiento e identificación de los constituyentes químicos en la capa exterior de la semilla de Ginkgo biloba [J]. Chinese Herbal Medicine, 1995, 26(6): 290-292, 328.
[9] Li Hongqing, He Zhaofan, Zhang Yongmin, et al. Investigación sobre los componentes hidroxifenóy ácido hidroxifenóen la capa exterior de la semilla de Ginkgo biloba [J]. Chinese Herbal Medicine, 2004, 35(1): 18-20.
[10]KOZUBEK A,TYMAN J H. Lípidos fenófenóbiobio[J]. Estudios en química de productos natu- ral,2005,30: 111-190.
[11] Cao Fuliang. The Ginkgo Biloba Journal of China (en inglés). Beijing: China Forestry Publishing House, 2007.
[12] [12]HESK D,CRAIG R,MUMMA RO. Comparación de la capacidad bioenzimdel ácido anacárdico entre Resistente a los insectos Y susceptible Geranios [J]. Journal of Chemical Ecology,1992,18(8) : 1349-1364.
[13]GEDAMP H,SAMPATHKUMARAN P S. Fabricación a partir de Líquido de la concha: Ex- tracción, química and Solicitudes [J]. Progresos progresos in orgánico Recubrimientos, 1986,14 (2) : 115-157.
[14] Wu Haixia, Wu Caie, Liu Jinda, et al. Purificación, identificación y actividad antibacteriana de ginkgodos de semillas de Ginkgo biloba. Chinese Journal of Food Science, 2015, 15(3): 207-215.
[15] Tian ZP, Yu W, He GZ, et al. Determinación del ácido ginkgo total en hojas de ginkgo biloba por HPLC [J]. Research on Trace Elements and Health, 2015, 32(2): 36-37, 47.
[16] He Jingren. Investigación sobre la alergenicidad y el mecanismo de acción del ácido ginkgo [D]. Wuhan: universidad agrícola de Huazhong, 2003.
[17] Liu Junfeng. Investigación sobre el proceso de eliminación de ginkgolides del polvo de ginkgo [D]. Tai'an: universidad agrícola de Shandong, 2017.
[18] CHEN H Y,CHENG K C,HSU R J,et al.degradación enzimdel ácido ginkgolic por laccase inmovilizon novel electrospun nanofiber mat [J]. Journal of the Science of Food and agriculture,2020,100(6) : 2705- 2712.
[19] Liang Lixing. Estado de la investigación y perspectivas de desarrollo de la capa exterior de semillas de ginkgo [J]. China Resources Comprehensive Utilization, 2003, 21 (10): 12-14.
[20] Zhao Chenglin. Extracción y discusión medicinal de componentes ácidos en la capa exterior de la semilla de ginkgo [J]. Chinese Herbal Medicine, 1997, 28(4): 250-251.
[21] Ji Yuliang. Estudio preliminar sobre la inhibición de bacterias patógenas de cultivos por extracto de cobertura de semillas de ginkgo biloba [J]. Anhui Agricultural Science, 2005, 33(9): 1598-1603.
[22] Xu Lichun, Tong Kun, Gu Weirong, et al. Estudio Experimental sobre la inhibición del crecimiento de hongos por intermediarios extraídos de la capa exterior de la semilla de ginkgo [J]. Medicina tradicional China, 1990, 13(6): 36-37.
[23]MUROI H,KUBO I. Actividad antibacteriana del ácido anacárdico y totarol,a- Lone and in La combinación with Meticilina, contra Resistente a la meticilina Staphylococcus aureus[J]. revista of applied Bacteriology,1996,80(4) : 387-394.
[24] Shi Qitian. Investigación sobre prevención y control de plagas agrícolas por ginkgolides [J]. Forest Chemical Industry, 2004, 24 (2): 84-87.
[25] Deng Yecheng, Xu Hanhong, Lei Ling. Toxicidad por contacto del extracto de ginkgo biloba contra tres plagas agrícolas [J]. Journal of South China Agricultural University, 2004, 25(3): 61-63.
[26]HILL G A,MATTACOTTI V,GRAHAMW D. El principio tóxico de la hiedra venenosa [J]. Journal of the American Chemical (en inglés) Sociedad,1934,56(12) : 2736-2738.
[27] Cheng Liang, Lou Fengchang. Descripción de la investigación de ginkgolides en la capa exterior de la semilla de Ginkgo biloba [J]. Avances en farmacia, 2004, 28(5): 209-213.
[28]VINCIERI F F,VINCENZINI M T,VANNI P. Extracción de compuestos activos de la sarcotesta de Ginkgo bilobaseed: inhibición de la actividad de algunas dehidrogenasas [J]. Journal article,2013,63(2) : 79-82.
[29]AHLEMEYER B,SELKE D,SCHAPER C,et al.los ácidos ginkgolic inducmuerte neuronal and Activar activar Proteínas proteínas Fosfatasa tipo 2C[J]. European Journal of pharmacology,2001,430(1) : 1-7.
[30] Yang Jianting, Wu Cae. Progreso de la investigación sobre los componentes alergénicos del Ginkgo biloba y su mecanismo de sensibilización [J]. Food Science and Technology, 2009, 34 (6): 282-286.
[31]AL-YAHYA A A,AL-MAJED A A,AL-BEKAIRI A M,et al.Studies on the Reproductive,cytological and bioquímicos toxicity of Ginkgo biloba in Swiss albino mice[J]. Journal of ethnopharmacology,2006,107 (2) : 222- 228.
[32]JIANG L,SI Z H,LI M H,et al.1 H estudio metabolómico basado en NMR del daño hepático inducido por ginkgolicacid (15 − 1) en ratones [J]. Journal of phar- maceutical and biomedical analysis,2017,136: 44-54.
[33]YAO Q Q,LI L,XU M C,et al.The Metabolismo y hepatotoxicidad Ginkgolicácido (17 − 1) in vitro[J]. Chino diario Fabricación natural Medicines, 2018,16(11) : 829-837.
[34]QIAO L N,ZHENG J B,JIN X Z,et al.el ácido ginkgolico inhila la invasión de las células cancerosas de colon mediante la activación de AMPK [J]. Oncology let- ters,2017,14 (5) : 5831-5838.
[35] LIANG J R,YANG H. Ginkgolic Ácido (GA) suprime gástrico Crecimiento del cáncer de cáncer by inducing y suprimisuprimir Señalización STAT3/JAK2 regulada por ROS[J/OL]. biomedicina & Pharmacotherapy,2020,125 [2020-03-21]. HTTPS: ∥doi. Org / 10.1016/j.biopha.2019.109585.
[36]LIU Y X,YANG B,ZHANG L R,et al.el ácido ginkgolic induce la interacción Entre la autofagia regulated by ROS Generación generación in colon Cáncer [J]. bioquímica and biofísica research Communications,2018, 498(1) : 246-253.
[37]WALTERS D S,CRAIG R,MUMMA R O. Incorporación de ácidos grasos en la biosíntesis de ácidos anacárdicos de geranios [J]. Phytochemistry,1990,29 (6) : 1815-1822.
[38]SINGHAL R A. Identificación identificación and Caracterización caracterización caracterización De genes involved in Metabolismo del monoeno n5 Precursores precursores to n5 anacardic acids in the Tri-chomes de Pelargonium x hortorum[D]. Louisville: universidad of Louis- ville,2016.
[39]NARNOLIYA L K,KAUSHAL G,SINGH S P,et al.De novo transcriptoma Análisis de Con aroma de rosa geranium Proporciona información sobre el metabolismo Especificidad de la biosíntesis de terpeny ácido tartári[J]. BMC Genomics,2017,18(1) : 1-14.
[40] Wu Yongmei, Mao Xue, Wang Shujian, et al. Ingeniería metabólica de ácidos grasos de la planta − -7 [J]. Acta Botanica Sinica, 2011, 46(5): 575-585.
[41]SCHULTZ D J,CAHOON E B,SHANKLIN J,et al.expresión de a − 9 14: El gen desaturasa del ácido graso es necesario para la producción de − 5 Ácidos anacárdicos encontrados en geraniresistente a plagas (Pelargoni- um xhortorum) [J]. procedimiento of the Academia nacional de Academia nacional de Sciences,1996,93(16) : 8771-8775.
[42]SHI S P,MORITA H,WANIBUCHI K,et al.síntesis enzimde poliketides de plantas [J]. Síntesis orgánica actual,2008,5(3) : 250-266.
[43] Li Mengjun, Shi Zhanliang, Guo Jinkao, et al. Análisis de secuencias de la proteína transportadora de acilo de la planta [J]. Journal of North China Agricultural University, 2010, 25(S1): 1-6.
[44]KOGLIN A,MOFID M R,LHR F,et al.conmutadores modu- proteína tardía Interacciones interacciones in Peptide antibiótico sintetasas [J]. Science, 2006,312 (5771) : 273-276.
[45] Li Lu, Liang Qian, An Xi, et al. Análisis bioinformático de la familia del gen perilla - cetoacil ACP sintasa [J]. Shanxi Agricultural Science, 2017, 45(3): 321-324.
[46] Hao Qingting. Identificación y análisis funcional del gen de la familia -cetoacil-acp sintasa II (KAS II) en algodón de tierras altas [D]. Taigu: universidad agrícola de Shanxi, 2018: 59.
[47]KACHROO A,SHANKLIN J,WHITTLE E,et al. Arabidopsis stearoil - acil carrier protein-desaturase Family and the contribution of Leaf isoforms To oleic acid synthesis[J] (en inglés). Plant molecular Biology,2007,63(2) : 257-271.
[48]TAHA R S,ISMAIL I,ZAINAL Z,et al El promotor de desaturasa (Des) de la palma aceitconfiere la expresión GUS específica de la fruta en el tomate transgé[J]. Journal of La plantaphysiology,2012,169(13) : 1290-1300.
[49]WANG H L,CAO F L,ZHANG X W,et alclonación and expression Of stearoil-acp desaturase and two oleate desaturases genes from Ginkgo bi- loba L.[J]. Plant molecular Biology Reporter,2013,31 (3) : 633-648.
[50] Liu Xinliang, Cai Jinfeng, Wang Huanli, et al. Respuesta del gen Ginkgo biloba SAD al estrés abiótico y expresión procariótica [J]. Journal of Northeast Forestry University, 2015, 43(12): 1-6.
[51]NAKANO C,OZAWA H,AKANUMA G,et al.biosíntesis of Poliketides alifáticos por poliketide sintasa tipo III y metiltransferasa en Ba- cillus subtilis[J]. Journal of bacteriology,2009,191 (15) : 4916-4923.
[52] JEZ J M,AUSTIN M B,FERRER J L,et al.estructural control Of polyketiin plantspecific polyketide synthases[J] (en inglés). Química & Biología,2000,7 (12) 919-930.
[53] Liu Jingying, Tong Shaoming, Hou Hesheng. Progreso de la investigación y estado de aplicación del gen qhe [J]. Tianjin Agricultural Science, 2015, 21(4): 24-27.
[54]AUSTIN M B,BOWMAN M E,FERRER J,et al.An aldol switch discov- ered in stilbene sintasa mediadores ciclación especificidad of tipo III Poliketide sinthases [J]. Química y biología,2004,11 (9) 1179-1194.
[55]COSTAGLIOLI P,JOUBS J,GARCIA C,et al.Profiling candidate genes Participa en la biosíntesis de cera en Arabidopsis thaliana por microarray analy- sis[J]. Biochimica et biophysica acta,2005,1734 (3) : 247-258.
[56]JAMES D W,JR,LIM E,KELLER J,et al.dirigió el etiquetado del gen Arabi- dopsis graso elong1 (FAE1) con el activador transpo- son de maíz [J]. The La plantacell,1995,7 (3) : 309-319.
[57]GAGNE S J,STOUT J M,LIU E,et al.Identification of olivetolicacid ciclasfrom Cannabis sativa revela a unique Catalizador catalcatalizador ruta to plant Poliketides [J]. Proceedings of the National Academy of Sciences,2012,109 (31) : 12811-12816.
[58] Maiti, A. R., y Maji. Avances en la investigación sobre la nueva familia de proteínas multifuncionales DABB. Genomics and Applied Biology, 2018, 37(12): 5460-5472.
[59] Fukui,ITO A,HIRAI G,et El ácido al.Ginkgolic inhiproteína SU- moilación bloqueando la formación del intermediario E1-SUMO [J]. Chem- istry & Biology,2009,16(2) 133-140.
[60]SCHULTZ D J,WICKRAMASINGHE N S,KLINGE C M. Capítulo seis - biosíntesis de ácido anacardico Y bioactividad [M] × ROMEO J T. reciente Avances en fitoquímica. Amsterdam: Elsevier,2006: 131-156.
[61]ECKERMANN C,MATTHES B,NIMTZ M,et al.enlace covalente de Chlo - roacetamida herbicidas to the active Sitio web cisteína of plant type III Poliketide sinthases [J]. Phytochemistry,2003,64 (6) : 1045-1054.
-
anterior
Cómo extraer Ginkgo flavona?
-
siguiente
Chamomile Extract Ingredient: Empowering Natural Cosmetics Formulation


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




