¿Cómo producir D arabinosa?
D Arabinitol is an important natural product that is widely found in lichen plants ysome food-derived fungi. However, its natural content is low, yit requires a large amount deraw materials in traditional processes, which seriously affects its economic benefits ymakes it unsuitable for large-scale production [1,2]. The chemical catalytic method uses nickel as a catalyst to undergo redox reactions, reducing arabinose to generate D-arabinitol. This is currently the most mainstream method for the industrial production deD-arabinitol [3]. Although the chemical catalytic method can achieve industrial scale in the marketand the production technology is relatively mature, the production procesorequires the use deexpensive catalysts and strict control deconditions such as high temperature (100°C) and high pressure (40-60 bar) [4]. This not only pollutes the environment but also makes it difficult to separate and purify the subsequent products, resulting in high production costs [5].
En comparación con el método catalítico químico, las condiciones de producción requeridas para la producción biológica de D-arabinitol son más suaves. La conversión de sustancias se logra por el crecimiento y metabolismo de microorganismos, y el producto obtenido es fácil de separar y puri, y la pureza y rendimiento de D-arabinitol se puede mejorar [6,7], que está más en línea con el concepto de ser verde, económico y respetuoso con el medio ambiente. Hay dos métodos biológicos principales: fermentación microbiana y transformación celular en reposo. El método de fermentación microbiana genera principalmente D-arabinitol mediante la conversión de sustrtales como glicer, xilosa, lactosa, glucosa y xilitol durante el crecimiento y metabolismo microbi[8,9]. El método de transformación de células en reposo se basa principalmente en la recolección y el enriquecimiento del líquido bactericultivado para preparar células en reposo, y utiliza varias enzimas presentes en las células en reposo para convertir D-arabinitol.
En resumen, los métodos para producir D-arabinitol cada uno tiene sus propias características, pero el método biológico tiene las ventajas de ser ecológico, económico y respetuoso con el medio ambiente, ya que logra la conversión de sustancias a través del crecimiento normal y el metabolismo de los microorganismos. Además, los productos del método biológico son fáciles de separar y puri, lo que mejora la pureza y el rendimiento de D-arabinitol. Aunque el método catalítico químico sigue siendo el principal método de producción, el método biológico se ha convertido o se está convirtiendo en una alternativa más prometedora.
1. Estado actual de la investigación de la producción biológica de D-arabitol
La levadura tolerante a alta presión osmótica es el principal microorganismo en la naturaleza que puede producir D-arabitol. Bajo alta presión osmótica, las células de levadura pueden sintetizar y acumular polioles para hacer frente al estrés por deshidrat, proteasí a las células del daño. En 1956, Spencer et Al.encontraron que la levadura tolerante a alta presión osmótica podría producir una variedad de polioles a través de la fermentación de la glucosa, incluyendo D-arabitol[10]. En 1969, Onishi et al. descubrieron que la glucosa podría convertirse en xilitol bajo la acción de los microorganismos, y que el D-arabinitol era un producto intermedio [11,12]. Este descubrimiento sentó las bases teóricas para la producción biológica de xilitol y atrajo la atención generalizada de los estudiosos en el país y el extranjero.
At present, research on the production deD-arabinitol mainly focuses on strain screening and fermentation condition optimization. For example, Song Weibin et al. screened a strain of Saccharomyces cerevisiae that produces D-arabinitol desdepollen, and improved the conversion rate after optimizing the fermentation conditions [12]. Li Ze et al. isolated a strain of Pichia pastoris L-84 from soil microorganisms that is resistant to high osmotic pressure and produces D-arabinitol, and carried out large-scale fermentation in a fermenter [13]. Saha et al. used a strain of Rhodotorula glutinis NRRLY-27624 obtained by screening from a wild honeycomb to optimize the fermentation conditions and finally achieve the fermentation of glucose to produce D-arabinitol, with a conversion rate of 48% [14][15].
Zhang Lili aislcon éxito una cepa de alto rendimiento de D-arabitol de Debaryomyces hansenii y estableció un modelo cinético para la fermentación de D-arabitol [16]. Nozaki examinó una cepa de Rhodotorula kofmei AJ14787 que produce D-arabitol de manera eficiente. La optimización de la fermentación se llevó a cabo mediante la combinación del cultivo a temperatura variable y la alimentación continua de 700 g/L de glucosa, y finalmente se produjo D-arabitol por fermentación 206 g/L[17]. Cheng et al. aplicaron la evolución adaptativa a las cepas de Pichia pastoris, y el rendimiento se incrementó en un 72,7% en comparación con el tipo silvestre [18].
M Povelainen et al. construyeron una bacteria de ingeniería Bacillus subtilis ATCC31094 que produce D-arabitol, que tiene una eficiencia de conversión de hasta el 38% y tiene buenas perspectivas de aplicación [19]. Investigadores posteriores han encontrado que los géneros Candida[20], Kluyveromyces[21], Kodamea[22,23], Hansenula[24,25] y Debaryomyces[26] son capaces de producir D-arabitol[27].
2. Vías metabólicas para la producción biotecnológica de D-arabinitol
En la investigación actual, se ha encontrado que los sustratos tales como la glucosa,xi«[28], glicer[29,30] y lactosa [31] se pueden utilizar para la producción de D-arabinitol. Vale la pena señalar que la glucosa y la xilosa se encuentran entre las dos principales reservas de fuentes de carbono en la naturaleza, y por lo tanto son ampliamente considerados como los sustratos más rentables. De acuerdo con los informes de investigación existentes, la ruta metabólica para la producción de D-arabitol a partir de glucosa incluye principalmente dos vías sintéticas, mientras que la posible ruta metabólica para la producción de D-arabitol a partir de xiosa sólo tiene una, la ruta del xilitol. Las tres vías metabólicas comunes del D-arabitol se muestran en la figura 1.2.
Figura 1. Vía metabólica de Darabitol
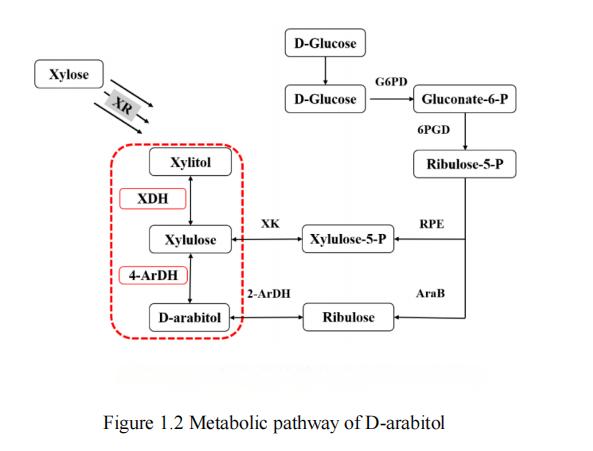
Existen dos vías sintéticas para el proceso metabólico de la producción de darabitol a partir de glucosa: la vía de la ribulosa y la vía de la xilulosa. En estos procesos, la glucosa es primero fosforilada a glucosa-6-fosfato, y luego convertida a 5-fosfod-ribulosa a través de la vía de la pentosa fosfato (vía PPP), que es un precursor común para las vías de ribulosa y xilulosa. La conversión de 5-fosfod-ribosa a d-ribulosa por la quinasa ribulosa y luego a D-arabinitol por 2-ArDH forma la vía ribulosa. En la otra vía metabólica, la 5-fosfod-ribosa es isomeria d-xilulosa-5-fosfato y luego desfosforilada a d-xilulosa. A continuación, D-arabitol 4-deshidrogenasa se convierteXilulosa a D-arabitolFormando así la vía de la xilulosa [32].
La ruta metabólica para la producción de D-arabitol a partir de xilosa implica principalmente una ruta sintética, la ruta del xilitol. En este proceso, la xilosa reductasa primero convierte la xilosa en xilitol. Posteriormente, xilitol deshidrogenasa (XDH) reduce xilitol a d-xilulosa. Finalmente, la D-arabitol deshidrogenasa (ArDH) convierte la d-xilulosa en D-arabitol, completando así la síntesis de la vía del xilitol.
En resumen, la glucosa y la xilosa, como dos sustratos comunes y de bajo costo en la ingeniería biometabólica, pueden ser utilizados para producir D-arabinitol a través de varias vías como la ruta de la pentosa fosfato, la ruta de la xilulosa y la ruta del xilitol. Estas rutas metabólicas proporcionan a los investigadores con una gran cantidad de estrategias de biosíntesis, que ayudarán a explorar y optimizar el proceso de producción de D-arabinitol para satisfacer las necesidades de los alcohode azúcar funcionales en aplicaciones prácticas.
3. Factores que afectan a la producción de D-Arabinitol por fermentación microbiana
Durante el proceso de fermentación, el rendimiento de D-arabinitol puede estar restringido por varios factores. En la actualidad, el rendimiento de D-arabinitol puede ser efectivamente aumentado mediante la optimización de las condiciones de fermentación, tales como pH, temperatura, carbono y la composición de la fuente de nitrógeno, el tamaño del inóculo, la velocidad de rotación y la concentración de oxígeno disuelto [33,34]. Estos factores están estrechamente relacionados con los procesos metabólicos del huésped de producción. Al ajustar estos parámetros, se pueden establecer condiciones ideales de fermentación para aumentar el rendimiento de fermentación.
En la actualidad, la mayor parte de la investigación sobre la producción biológica de D-arabinitol se centra en la fermentación de D-arabinitol a partir de glucosa, y hay menos investigación sobre la producción de D-arabinitol a partir de xilosa. Se sabe que muchas levaduras producen D-arabinitol durante el crecimiento de la glucosa, pero pocas levson conocidas por producir D-arabinitol a partir de xilosa. En 2018, Jagtap et al. [28] informaron por primera vez que Rhodosporidium toruloides IFO0880 puede producir D-arabinitol a partir de xilose en un medio rico en nitrógeno. Esta es la primera vez que se ha descubierto que una levadura natural puede utilizar xilosa como la única fuente de carbono para producir D-arabinitol, lo que confirma la existencia de una vía de xilitol en el proceso metabólico de la producción biológica de D-arabinitol. En este proceso, la xilosa se convierte primero en xilitol por xilosa reductasa. Posteriormente, xilitol es reducido a d-xilulosa por XDH. Finalmente, ArDH convierte la d-xilulosa en D-arabinitol.

Una mayor concentración de sustrinicial puede ejercer presión osmótica sobre la cepa de fermentación, promoviendo la reacción de bioconversión hacia adelante y por lo tanto aumentar el rendimiento de D-arabitol. Por ejemplo, durante la fermentación de Debaryomyces hansenii SBP-1, el uso de 150 g/L de xilosa puede aumentar el rendimiento de D-arabitol en 2,23 veces en comparación con el uso de 70 g/L de xilosa. Durante la fermentación con Debaryomyces hansenii NRRLY-7483, el uso de 1,5% de glicerpuede aumentar la producción de D-arabitol por 4 a 5 veces en comparación con 0,5% de glicer[35]. Durante el crecimiento y metabolismo de Candida Candidasp. H2 [36], la producción de D-arabinitol aumentó significativamente con el aumento de la concentración de glucosa, con 250 g/L de glucosa siendo la concentración inicial óptima de azúcar. Sin embargo, una concentración de sustrdemasiado alta también puede ser perjudicial para la síntesis de D-arabitol. Por ejemplo, durante el cultivo de Zygosaccharomyces rouxii JM-C46, la producción de D-arabitol no aumentó más cuando la concentración de glucosa se incrementó de 200 g/L a 250 g/L.
Nitrogen sources are key elements in microbial fermentation systems and are closely related to the regulation of microbial growth and metabolism. For example, the optimal nitrogen source for Candida sp. H2[37] and Candida quercitrusa is yeast extract, while ammonium sulfate is the optimal nitrogen source for Pichia Manchurica[38] and Debaryomyces Hansenii. Kumdam[39] and Loman[40] found that adding an appropriate amount of nitrogen source to the medium can increase the production of D-arabitol. Similarly, Jagtap et al. found that Rhodosporidium toruloides IFO0880 can convert xylose to produce high titers of D-arabitol in nitrogen-rich media. The yield of D-arabitol increased with the increase of nitrogen content in the medium. However, high nitrogen concentrations may be detrimental to the production of D-arabitol by Kluyveromyces ohmeri strains [41].
Durante la fermentación microbiana, la adición de la cantidad correcta de iones metálicos puede mantener el equilibrio de presión osmótica del fluido intracelular, mejorar la actividad de las enzimas intracelulares, y promover el crecimiento y metabolismo microbi. Yoshikawa estudió el efecto de los iones metálicos en la producción de D-arabinitol por Candida quercitrusa y encontró que los iones de calcio promueven la producción de D-arabinitol. La razón es que los iones de calcio penetran en la célula y aumentan la actividad de las enzimas en el crecimiento celular y la ruta del metabolismo. En otro estudio, Kumdam [42] y Sundaramoorthy encontraron que el zinc, el hierro, el mangany los iones de cobre pueden promover el metabolismo de crecimiento de las cepas de Debaryomyces nepalensis y Pichia Manchurica y aumentar la producción de D-arabinitol.
3.1 xilitol deshidrogenasa
Xilitol deshidrogenasa es una enzima limitante clave en la ruta biosintética para la producción de D-arabinitol. XDH juega un papel vital en el metabolismo de la xilosa por los microorganismos para producir D-arabinitol. Como una enzima redox reversible, la actividad catalítica de XDH depende de los cofactores NAD+ y NADH [43,44].
This enzyme is mainly found in yeasts that ferment xylose to produce xylitolTales como Paecilomyces taphios, Candida shehatae, y Pichiastipitis [45]. Los hongos filamentosos como Fusarium oxysporum y Neurospora crassa también son fuentes importantes de XDH. Vale la pena señalar que la secuencia central activa de estos XDHs de diferentes especies está altamente conservada [46].
Masakazu et al. [47] clonó el gen XDH de Gluconobacter oxicanos ATCC621, Zhang et al. [48] estudió el gen XDH en Gluconobacter oxicanos NH-10, y Qi et al. [49] clonó el gen XDH de Gluconobacter oxicanos CGM CC 1.49.
Estos investigadores clonaron genes XDH de diferentes cepas y los expresaron con éxito en Escherichia coli BL21. También estudiaron las propiedades enzimde XDH y encontraron que las propiedades enzimde estos XDHs de diferentes fuentes son similares hasta cierto punto. Estudios posteriores han encontrado que XDH pertenece a la familia de la deshidrogenasa de cadena corta. En la reacción de oxidde xilitol con NAD+ como coenzima, el pH óptimo de XDH es 11; Mientras que en la reacción de reducción de d-xilulosa con NADH como coenzima, el pH óptimo de XDH es 5. Por lo tanto, puede inferirse que el pH óptimo de XDH en la reacción de oxidestá en el rango alcalino, mientras que el pH óptimo en la reacción de reducción está en el rango ácido.
En resumen, XDH es biológicamente importante. Las propiedades enzimáticas de XDH en diferentes cepas varían, pero todas comparten un cierto grado de similitud en términos de secuencia proteica y propiedades enzimáticas. La investigación actual muestra que XDH tiene diferentes valores óptide pH bajo diferentes condiciones de reacción, lo que proporciona una base para la investigación y la aplicación de la enzima.
4 modificación Molecular
XDH tiene diversas propiedades catalíticas y juega un papel importante en la biocatálisis. Sin embargo, las enzimas naturales todavía tienen limitaciones en términos de actividad, espectro de sustry especificidad catalítica, lo que hace difícil alcanzar un nivel ideal de rendimiento del producto. En los últimos años, las estrategias de ingeniería de proteínas como la evolución dirigida, el diseño racional y el diseño semi-racional han sido ampliamente utilizados en la modificación de enzimas. Estas estrategias pueden mejorar eficazmente el rendimiento de las enzimas para satisfacer mejor las necesidades reales de producción.
5 evolución dirigida
Desde que Frances H. Arnold propuso por primera vez el concepto de evolución dirigida en 1993, este campo ha hecho un progreso notable en las últimas décadas [50]. La idea básica de la evolución dirigida, que juega un papel importante en la ingeniería enzim, es simular el proceso de evolución natural, introducir mutaciones aleatorias artificiales, y detectar mutantes de alto rendimiento.
Además, la estrategia de evolución dirigida tiene la ventaja de que puede modificar efectivamente la función de las enzimas sin una profunda comprensión de su estructura, función y mecanismo catalítico. Los principales pasos de la estrategia de evolución dirigida incluyen la construcción de mutantes y el cribado de bibliotecas mutantes. Este proceso utiliza la mutación aleatoria y técnicas de recombinación genética como la PCR propensa a errores y el shuffling del ADN [51].
La aplicación de estas técnicas ha mejorado enormemente la eficiencia de la construcción de mutantes y la diversidad de las bibliotecas mutantes. Sin embargo, la implementación de estrategias de evolución dirigida enfrenta algunos retos, especialmente en la etapa de screening de alto rendimiento [52]. El screening de alto rendimiento, como método para identificar y seleccionar rápidamente mutantes superiores, es crítico para el proceso de evolución dirigida [53].
El método de filtrado de alto rendimiento para una biblioteca mutante específica debe ser específicamente diseñado de acuerdo con el producto de destino, por lo que no hay un método de filtrado universal. El diseño específico y los desafíos del proceso de cribado en esta etapa sin duda se suman a la complejidad de la estrategia de evolución dirigida. En general, a pesar del diseño específico y los desafíos del método de detección de alto rendimiento, la tecnología de evolución dirigida todavía se considera una herramienta eficaz para la ingeniería molecular de enzimas. Sus importantes contribuciones y las continuas tendencias de desarrollo indican que este campo seguirá desempeñando un papel importante en la biotecnología y otros campos afines.
Referencia:
[1]Escalante J, Caminal G, Figueredo M, et al. producción of arabitol from 1 % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % % revista De la fermentación and La biotecnología 1990,70(4):228-231.
[2]Moran J W, Witter L D. Efecto de los azúcares sobre la producción de darabitol y el metabolismo de la glucosa en Saccharomyces Ruxii [J].revistaof Bacteriology, 1979,138(3):823- 831.
[3]Murthy SN, Kumdam H, Gummadi SN. Producción de Arabitol por fermen- tation-biosynthesis microbiana Y aplicaciones futuras [J].International revistaof Sciences Basic & Investigación aplicada, 2014, 1:1-12.
[4]Kumdam H, Narayana M S, Gummadi S N. producción de etanol y arabitol por Debaryomyces nepal: influencia of proceso Parámetros [J]. AMB Express, 2013,3(1):23.
[5]Zhang G, LinY, He P, et al. Caracterización de la levadura Pichia, productora de alcohol de azúcar Anomala [J]. Journal of Industrial microbiología & Biotechnology, 2014,41(1):41-48.
[6] Huang Wei, Wang Xiaodan, Li Dounan, et al. Avance de la investigación sobre la fermentación microbiana de D-arabitol [J]. China Brewing, 2017, 36(09): 6-10.
[7] Ding Xiaobing, Li Zongwei, Yang Zhuanqin, et al. Cromatode papel mejorada para determinar el contenido de isoleucina en líquido productor de enzimas [J]. Ciencia y tecnología de la industria alimentaria, 2009, 30(08): 314-315.
[8] Akinosho H, Rydzak T, Borole A, et al. Desafíos toxicola la producción de bioetanol microbiy estrategias para mejorar la tolerancia [J]. Ecotoxicology, 2015, 24(10):2156-2174.
[9] Qian Weidong, Ning Xiaoxiao, Wang Lan, et al. Método de detección rápida para cepas de levadura D-arabinitol de alto rendimiento [J]. Journal of Shaanxi University of Science and Technology, 2014(6):129-133.
[10] Spencer J F T, Sallans H R. producción de alcohopolihídricos por levosmofílicas [J]. Canadian Journal of Microbiology, 1956, 2(2):72-79.
[11] Onishi H, Suzuki T. producción microbiana de xilitol a partir de glucosa [J]. AppliedMicrobiology, 1970, 18(6):1031-1035.
[12] Song Weibin, Lin Yanqing, Hu Haiyan, et al. Selección e identificación de cepas productoras de D-arabitol y optimización de las condiciones de producción de D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[13] Li Zé, Zhao Xiangying, Liu Jianjun. Screening e identificación de cepas de levaduras productoras de D-arabinol [J]. Food Industry, 2012, 33(10): 27-30.
[14]Guo Q, ZabedH, Zhang H, et al. Optimización del medio de fermentación para una cepa de levadura recientemente aislada (Zygosaccharomyces rouxii JM-C46) y evaluación de los factores que afectan a la biosíntesis de darabitol [J]. Ciencia de los alimentos & Tecnología, 019,99:319- 327.
[15]Saha B C, SakakibaraY, Cotta M A. producción de darabitol por un nuevo aislado de Zygosaccharomyces rouxii[J]. Journal of Industrialmicrobiologíaand Biotechnol- ogy, 2007,34(7):519-523.
[16] Zhang Lili. Selección de cepas de levadura D-arabinitol de alto rendimiento y estudio de sus condiciones de fermentación [D]. Universidad Jiangnan, 2009.
[17]Nozaki H, Suzuki S, Tsuyoshi N, et al. Producción de darabitol por Metschnikowia reukaufii AJ14787[J]. bioci, biotecnología and Biochemistry, 2003,67(9):1923-1929.
[18]Cheng H, Lv J, Wang H, et al. Levadura Pichiapastoris genéticamente modificada para la conversión de glucosa en xilitol mediante un proceso de fermentación simple [J]. Applied Mi- crobiology and Biotechnology, 2014,98(8):3539-3552.
[19]Zheng S, Jiang B, Zhang T, et al. Mutagenesis combinada y regulación metabólica para aumentar la producción de darabitol a partir de Candida parapsilosis[J]. Journal of Indus- trial microbiología& Biotechnology, 2020,47(4):425-435.
[20] Wang L, Hui M, Yin Y, et al. Aislamiento y cribado de una cepa de D-arabitol de alto rendimiento [J]. Journal of Food Safety and Quality Testing, 2014, 5(12):4018-4025.
[21] Toyoda T, Ohtaguchi K. efecto de la temperatura en la producción de Darabitol a partir de lactosa por Kluyveromyces lactis [J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(9):1179-1185.
[22] Cai Li, Zhang Yang, Zhu Hongyang, et al. Aislamiento, cribado e identificación de una cepa productora de D-arabitol [J]. Food and fermentación Industry, 2009, 35(01): 23-26.
[23] Saha B C, Cotta S M A. producción de d -arabitol por un Zygosaccharomyces recientemente aislado rouxii[J]. Journal of Industrial Microbiology & Biotechnology, 2007,34(7):519-523.
[24] Qian Weidong, Ning Xiaoxiao, Zhao Dezhi, et al. Mejorar la fermentación de Hansenula polymorpha para producir D-arabitol utilizando una estrategia de combinación [J]. Anhui Agricultural Science, 2014, 42(23): 7726-7728.
[25] Wang Gang, Tang Xiaofang, Zhang Guodong. Investigación sobre la conversión de la glucosa en arabitol por Hansenula anomala [J]. Shipin Gongye Ke-Ji, 2012(1):314-317.
[26] Zhang Lili, Liao Defang, Ding Chongyang, et al. Fermentación de glucosa por Hansenula polymorpha para producir D-arabitol [J]. Microbiología Industrial, 2010, 40(04):47-52.
[27] Yuan Dou. Ingeniería metabólica de Pichia pastoris y biosíntesis de D-arabinitol [D]. Universidad Jiangsu, 2022.
[28]Jagtap S S, Rao C V. producción de darabitol fromdxilosa por la levadura oleaginosa Rhodosporidium toruloides IFO0880[J]. Applied Microbiology and Biotech- nology, 2018,102(1):143-151.
[29]Yoshikawa J, HabeH, Morita T, et al. Producción de darabitol a partir de glicercrudo por Candida Quercitrusa [J]. Applied Microbiology and Biotechnology, 2014,98(7):2947-2953.
[30] Wang Huilian, Yang Lianwan, Na Shumin, et al. Investigación sobre la producción de glicery arabitol por levcon alta resistencia a presión osmótica III. Condiciones para la producción de glicerpor Zygosaccharomyces chevalieri Guill. 2.309 [J]. Acta Microbiologica Sinica, 1963(02):92-93.
[31] Toyoda T, Ohtaguchi K. papel de la lactosa en la producción de Darabitol por Kluyveromyces lactis cultivado en lactosa [J]. Applied Microbiology and Biotechnology, 2010, 87(2):691-701.
[32] Sun Wentao, Xu Hui, Liu Jianjun. Efecto de los aditivos sobre la fermentación del D-arabitol [J]. Food Science and Technology, 2013, 38(06): 12-16.
[33]Qi X, Zhang H, Magocha T A, et al. Mejora la producción de xilitol mediante la expresión de una novelDarabitol deshidrogenasa a partir de Gluconobacter sp. JX-05 aislado y co-bi- otransformación de células enteras [J]. Bioresour Technology, 2017,235:50-58.
[34]Ravikumar Y, Ponpandian LN, Zhang G, et al. Aprovechar la l-arabinosa isomerasa para la producción biológica dedtagatose: avances recientes y sus aplicaciones [J]. Tendencias en ciencia alimentaria & Tecnología, 2021,107:16-30.
[35]Koganti S, Ju L. Debaryomyces hansenii fermentación para la producción de arabitol [J]. Revista de ingeniería bioquímica, 2013,79:112-119.
[36] Song Weibin, Lin Yanqing, Hu Haiyan, et al. Selección e identificación de cepas productoras de D-arabitol y optimización de las condiciones de producción de D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[37]Song Weibin, Lin Yanqing, Hu Haiyan, et al. Aislamiento e identificación de una nueva Candida sp. H2 producdarabitol y optimización de la producción de darabitol [J]. Wei Sheng Wu Xue Bao, 2011,51(3):332-339.
[38]Sundaramoorthy B, Gummadi SN. Cribado de la nueva levadura Pichia manchurica para la producción de arabitol [J]. Journal of Basic Microbiology, 2019,59(3):256-266.
[39]Kumdam H, Narayana M S, Gummadi S N. producción de etanol y arabitol por Debaryomyces nepalensis: influencia Los parámetros del proceso [J]. AMB Express, 2013,3(1):23-28.
[40]Loman A A, Islam S, Ju L K. producción de arabitol A partir de hidrolizado enzimde harina de soja por fermentación de Debaryomyces hansenii [J]. Applied Microbiology and Biotechnology, 2018,102(2):641-653.
[41]Zhu H Y, Xu H, Dai X Y, et al. Producción de darabitol por un Ko- damaea ohmeri[J] recientemente aislado. Bioprocess and Biosystems Engineering, 2010,33(5):565-571.
[42]Kumdam H, Murthy S N, Gummadi S N. producción de etanol y arabitol por Debaryomyces nepal: influencia of process Parámetros [J]. AMB Express, 2013,3(1):1-12.
[43]Ehrensberger AH,EllingRA, Wilson DK. Ingeniería estructural guiada de xilitol deshidrogenasa especificidad de cosustr[J]. Estructura, 2006,14(3):567-575.
[44] Yuan junjua. Construcción de bacterias genéticamente modificadas basadas en la 1,3-propanediol deshidrogenasa de Clostridium butyricum y la biosíntesis celular completa de 1,3-propanediol [D]. Universidad de Jiangsu.
[45] Chen Gaoyun, Ye Kai, Tu Zhendong, et al. Progreso de la investigación de xilitol deshidrogenasa [J]. Brewing Science and Technology, 2011(5):4.
[46] Zhang Huanhuan. Clonación y expresión de xilitol deshidrogenasa y etanol deshidrogenasa genes de Gluconobacter oxydans y la biosíntesis de células enteras de xilitol [D]. Universidad Jiangsu, 2018.
[47]Sugiyama M, Suzuki S, Tonouchi N, et al. Clonación del gen xilitol deshidrogenasa de Gluconobacter oxydans y mejora la producción de xilitol fromD Arabitol [J]. Bioscience, Biotechnology and Biochemistry, 2003,67(3):584-591.
[48]Zhang J, Li S, Xu H, et al. Purificación de xilitol deshidrogenasa y mejora la producción de xilitol mediante el aumento de la actividad XDH y el suministro de NADH en glucono-bacteroxydans [J]. Journal of Agricultural and Food Chemistry, 2013,61(11):2861- 2867.
[49]Qi X, Zhu J, Yun J, et al. Aumento de la producción de xilitol: expresión de xilitol dehy- drogenasa de Gluconobacter oxydans y cultivo mixto de células en reposo [J]. Jour- nal of Bioscience and Bioengineering, 2016,122(3):257-262.
[50] He Peng. Modificación Molecular y análisis del mecanismo de la eficiencia catalítica mejorada del esteroide P450 dihidroxilasa CYP-cl3 [D]. Universidad Jiangnan, 2022.
[51] Luo Yan. Clonación y coexpresión de los genes arabitol deshidrogenasa y xilitol deshidrogenasa de Gluconobacter thailandicus D [D]. Universidad de Jiangsu, 2016.
[52] Zhang Yufei. Investigación sobre la coproducción de ácido 3-hidroxipropiónico y 1,3-propanediol por Lactobacillus reuteri [D]. Universidad Jiangsu, 2021.
[53] Yuan Jiao. Construcción de una bacteria genéticamente modificada basada en − -galactosidasa y l-arabinosa isomerasa y biosíntesis de D-tagatose [D]. Universidad Jiangsu, 2021.


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés