¿Cuál es el método de preparación de D tagatosa?
Dtagatosa is unrare six-carbon ketose sugar ennature. Its physical properties ysweetness are similar to sucrose. It has low energy content, can lower blood sugar, improve intestinal flora, yprevent toothdecay. Foreign researchers have studied its physiological functions yproducciónmethods enmore detail, yD-tagatosehas been used as a low-calorie edulcorantesenSalud saluddrinks, yogurt, fruit juice, yfoods paradiabetics in many countries. en2001, elUSLa comidaand Drug Administration (FDA) determinadoelnit was generally recognized as seguro(GRAS) [1]. There has been little research on tagatose in China, and there are many problems conits industrial production and its application also needs to be studied. However, elnumber depeople with diabetes and cardiovascular diseases is increasing year poryear in China, and eldemand parafunctional sweeteners is also growing. Therefore, D-tagatosehas great market potential in China.
1 D-tagatose
1. 1 propiedades físicas y químicas
D-tagatose is an isomer deD-galactose and a diastereoisomer deD-fructose (see Figure 1), with a relative molecular mass de180.16 u. Pure D-tagatose is a white, odorless, non-crystalline substance with a melting point de134 °C. It is stable in the pHrange de2 to 7. It is highly soluble in water, with a solubility de58% at 21°C. Its hygroscopicity is similar to that desorbitol, and its viscosity of 180 cP (70% (w/w), 20°C) is lower than that of sucrose, slightly higher than that of sorbitol and fructose [2]. elsweetness is similar to that of sucrose, with a sweetness level of 92% of sucrose, and the calories produced are only 1/3 of sucrose. The U.S. FDunhas confirmed it as a low-calorie sweetener with an energy value of 1.5 kcal/g (approximately 6280.2 J/g). In addition, D-tagatose is prone to the Maillard reaction and can caramelize at lower temperatures.
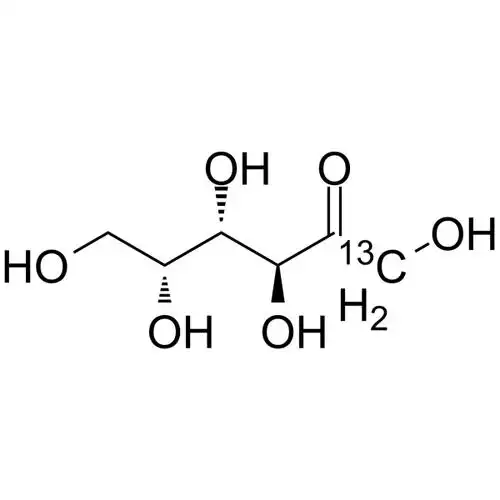
1. 2 funciones fisiológicas
(1) With low energy content, D-tagatose can be catabolized via the tagatose-6-phosphate pathway, which is present in some microorganisms but not in higher animals [3]. The absorption tarifaof D-tagatose in the small intestine is very low. The part that is not absorbed porthe small intestine reaches the large intestine and is completely fermented porthe intestinal microorganisms, producing a large amount of short-chain fatty acids that are almost completely absorbed and metabolized. The fermentation process produces relatively low amounts of energy, and there is also a loss of energy due to the increased excretion of microbial waste products. Therefore, the energy produced by the catabolism of tagatose is much lower than that of sucrose. If tagatose is used to replace sucrose in the diet, it can effectively reduce the incidence of obesity.
(2) reducir el azúcar en la sangre: los estudios han demostrado que no hay un cambio significativo en los niveles de azúcar en la sangre o insulina después de ingerir tagatose. La tagatosa también inhila la absorción de glucosa en el intestino delgado, lo que puede reducir eficazmente el aumento de azúcar en la sangre causado por la ingesta de glucosa en pacientes diabéticos, y tiene una función en la terapia adyuvpara pacientes diabéticos tipo 2.
(3) mejora la flora intestinal. La d-tagatosa es fermentselectivamente en el colon por alguna flora microbiana, promoviendo el crecimiento de bacterias beneficiosas. Es un buen prebiótico. Al mismo tiempo, la gran cantidad de ácidos grasos de cadena corta beneficiosos producidos por la fermentación de la d-tagatosa tiene un buen efecto en la inhibidel cáncer de colon, inhibide bacterias patógenas intest, y la promoción del crecimiento de bacterias beneficiosas [3]. Por lo tanto, la d-tagatosa puede mejorar la flora intestinal y mantener la salud intestinal.
(4) Anti-caries: D-tagatose is similar to polyols in protecting teeth. Debido aque produce bajos niveles de ácido en la boca y no baja el pHde la placa, puede prevenir eficazmente la aparición de caries y la erosión del esmalte [4].
2 D-Tagatosebiosynthesis (en inglés)
D-Tagatosecan be produced by bioconversion or chemical synthesis. Because chemical production of D-Tagatose is prone to the formation of impurities such as fructose, sorbitol and mannose, which require repeated crystallization to remove, this significantly reduces the yield of D-Tagatose. Therefore, bioconversion is being continuously researched as a better method.
El método de bioconversión para producir tagatosa utiliza principalmente la l-arabinosa isomerasa para catalizar la conversión de d-galactosa a d-tagatosa. La función natural de la l-arabinosa isomerasa (EC 5.3.1.4, l-arabinosa isomerasa, L-AI) es catalizar la conversión entre la aldose y la conversión mutua de la cetosa [5]. La investigación ha encontrado que también puede catalizar la conversión de d-galactosa a d-tagatosa, pero su afinidad por d-galactosa es menor que su afinidad por l-arabinosa.
2.1 fuentes nacionales
Las condiciones óptimas de reacción para L-AI varían dependiendo de la fuente. La temperatura de reacción óptima para L-AI de bacterias mesofílicas es de 30 a 50 °C, incluyendo Alicyclobacillus acidocaldarius, bacihalodurans, Escherichia coli y Lactobacillusgayon-ii. La temperatura óptima de reacción para L-AI de bacterias termófilas es de 60 a 80 °C, incluyendo Geobacillus Geobacillusstearothermophilus, G. thermodenitrificans, y Thermoanaerobacter mathrani. La temperatura de reacción óptima para L-AI de bacterias hipertermófilos es de 85-90°C, incluyendo termo - toga neapolitana y T. Maritima. Como la tasa de conversión de L-AI a d-tagatosa aumenta con el aumento de la temperatura, la mayoría de las fuentes anteriores de L-AI eran bacterias termófilas, como Bacillus stearothermophilusUS100 y Thermoanaerobacter mathrani. Sin embargo, estas bacterias termófilas no son microorganismos de calidad alimentaria, y su seguridad alimentaria es cuestionable. Por lo tanto, los investigadores han comenzado a utilizar microorganismos de calidad alimentaria para producir D-tagatose.
Los seres humanos han estado utilizando bacterias del ácido lácpara producir alimentos fermentados, tales como diversos productos lácteos durante miles de años. Lactococcuslactises actualmente uno de los organismos mejor reconocidos como seguros (GRAS), y también es un huésped de expresión eficaz para muchos productos proteicos diferentes. Además, el pHen el que crecen las bacterias del ácido láces el mismo que en el que se hidroliza la lactosa, lo que las convierte en una excelente opción para la bioconversión de la d-tagatosa. Actualmente, las cepas de calidad alimentaria de las bacterias del ácido lácque se ha demostrado que expresan L-tagatose incluyen Lactobacillus gayon-ii [6], Lactobacillus plantarum[7], Lactobacillus sakei 23K [8], y Lactobacillus fermentum, que fue descubierto en 2011 [9]. (Lactobacillus sakei 23K) [8] y Lactobacillus fermentum [9], una cepa de calidad alimentaria descubierta en 2011. El uso de cepas de calidad alimentaria hace que la producción enzimmicrobiana de la tagatosa sea más segura.
2. 2 modificación Molecular de L-AI
Aunque el gen araun(que expresa la proteína L-AI) se ha identificado en muchas especies, todavía hay muchos problemas con la producción industrial de L-AI. Por lo tanto, la modificación molecular de la L-AI para obtener una enzima que cumpla con los requisitos de la producción industrial se ha convertido en una parte importante de la investigación de la L-AI. Se ha determinado la estructura cristalina de E. coli L-AI, proporcionando una base para identificar la molécula responsable de la isomeride de la galactosa ala tagatosa. Rhimiet al. [10]determinaron los sitios catalíticos esenciales y de reconocimiento de sustrde de la l-arabinosa isomerasa de G. stearoothermophilus US100 sobre la base de la estructura cristalina y la secuencia. Con el fin de mejorar la tasa de conversión de d-galactosa, la modificación molecular de L-AI se centra principalmente en mejorar la especificidad del sustr, la resistencia al calor y la reducción del pHóptimo [11].
La evolución directa del gen L-AI fue considerada el método más efectivo para mejorar la velocidad de reacción [12]. Los investigadores obtuvieron un L-AI mude de G. stearothermophilusa través de la reacción en cadena de la polimerasa. La enzima tenía tres cambios de sitio de aminoácidos en comparación con la enzima silvestre, V322M, A393T y A408V. Esta variante de L-AI ha mejorado la actividad catalítica hacia la d-galactosa, la temperatura óptima, la eficiencia catalítica y el rendimiento de la d-tagatosa [13]. El grupo de investigación de Deok-Kun Ohllevó a cabo mutagenesis dirigida al sitio en L-AI de G. thermodenitrificanspara obtener una enzima con dos sitios mutantes (C450S-N475K). AI de G. thermodenitrificans fue sometido a mutagenesis dirigida al sitio para obtener una enzima mutante doble (C450S-N475K). Esta doble enzima mutante tuvo un rendimiento de d-tagatosa del 58%, en comparación con el 46% para la enzima de tipo silvestre [14].
Los estudios han demostrado que el Mn2 + y /o Co2 + son necesarios para la actividad y la estabilidad térmica de muchos L-AI. Sin embargo, en la producción de d-tagatosa por el método de la enzima biológica, la adición de altas concentraciones de iones metálicos también aumentará el costo de post-procesamiento. Por lo tanto, la búsqueda de iones metálicos independientes de L-AI con estabilidad térmica también se ha convertido en una dirección importante de la modificación molecular de L-AI. En la actualidad, la estructura tridimensional de E. coli L-AI se ha determinado, y un posible sitio de Unión al metal se ha especulado mediante la comparación de su estructura cristalina con la estructura cristalina de E. coli l-trehalosa isomerasa [15].
La producción industrial de d-tagatosa requiere L-AI para reaccionar en el rango de pHácido. Debido a que la d-tagatosa es estable a pH de 2 a 7, las condiciones ácidas pueden reducir las reacciones de pardeamiento. Por otra parte, la lactosa se utiliza generalmente como materia prima en la producción, y la lacnecesita ser hidrolizada a galactosa primero, y la hidrólisis de la lacocurre generalmente bajo condiciones ácidas (pH 5 a 6). La L-AI tolerante a ácidos adquirida incluye dos mutantes, Q408V y R408V (pHopt 7.5), obtenidos de una mutación GSAI (pHopt 8.5) dirigida al sitio [16]. En la actualidad, los sitios de aminoácidos que afectan a pHopt pueden ser determinados, incluyendo Val408 (GSAI) y Lys269 (AAAI, correspondiente a Glu268 de BHAI y Gln268 de BSAI). En el futuro, estos dos sitios pueden ser mutados u otros sitios de aminoácidos que afectan a pHopt se pueden encontrar sobre la base de la estructura cristalina de L-AI.
2. 3 expresión de L-AI
En la actualidad, Escherichia coli se utiliza a menudo como una célula huésped para producir L-AI. Sin embargo, la producción de endotoxinas en E. coli puede plantear un problema de seguridad. Por lo tanto, después de obtener el gen L-AI adecuado para la producción industrial y su aplicación, expresarlo en bacterias genéticamente modificadas de calidad alimentaria se ha convertido en un nuevo foco de investigación. Xuet al. [17] utilizaron el Lactobacillus fermentum CGMCC2921en lugar de Escherichia coli como vector de expresión de L-AI y lograron la expresión a gran escala de L-AI.Nooraet al. [18] transfiel gen L-AI a la bacteria del ácido láclactococcus lactis, lo que permite la expresión de L-AI en un sistema de expresión indupor la reducción de fosfato.
2. 4 producción de D- tagatosa utilizando biocatalizadores inmovilizados
Después de obtener bacterias modificadas con alta expresión de l-ai, se requiere la inmovilización de la enzima o de las células productoras de enzimas para mejorar la resistencia mecánica de la enzima y reducir la pérdida de actividad enzim. El grupo de investigaciónOhen la universidad nacional de Seúl en Corea del sur utilizó diferentes métodos de inmovilización como la adsorde gel de sílice, la microencapsulación, la incorporación de alginato de sodio, y la reticulde glutaraldehído para inmovilizar Escherichia coli L-AI y comparar los efectos de diferentes métodos de inmovilización en la tasa de conversión de d-tagatosa. Los resultados mostraron que el mejor efecto fue el preparado enzimobtenido por el método de alginato sódico clorcálcico para obtener granos inmovilizados y luego reticulcon glutaraldehído.
Al comparar la capacidad de las enzimas libres, las enzimas inmovilizy las células inmovilizpara producir d-tagatosa, los investigadores encontraron que usando la misma cantidad de células, el rendimiento de d-tagatosa producido por las células inmovilizera era el más alto. Además, el uso de células productoras de L-AI como catalizadores puede proteger mejor la enzima, prevenir la desnaturalización de la enzima, aumentar el número de lotes de reacción, y reducir las impurezas en la solución de conversión. Fu Fenggen et al. [19] estudiaron la capacidad de las células recombinde E. coli inmovilizpara producir d-tagatosa. Los resultados mostraron que el uso de d-tagatosa como sustrbajo condiciones óptimas de reacción durante 24 horas, el inmovilizó la mayor tasa de conversión de d-tagatosa, hasta un 65,8%, y la tasa de conversión promedio de 60,6% para 8 lotes consecutivos, sentando las bases para la producción industrial de d-tagatosa.
2.5 efecto del ácido bórico sobre el rendimiento de d-tagatosa
Además de aumentar la temperatura de reacción, otra forma de cambiar el equilibrio de reacción hacia la d-tagatosa es añadir ácido bórico [B(OH)4-] a la mezcla de reacción. El ácido bórico forma complejos complejos con diferentes azúcares, generalmente mostrando una mayor afinpor las cetosis que por las aldosis. Esta propiedad ha sido explotada, por ejemplo, para mejorar la formación de cetosa de aldoses en la separación cromatográfica de carbohidratos. Se ha demostrado que las sales de borato forman un complejo más estrecho con cetosas, por ejemplo, se unen más fácilmente con d-tagatosa que con d-galactosa, con l-ribulosa que con l-arabinosa, y con D-allulose que con d-fructosa. Además de aumentar la conversión, la presencia de un buffer de borato también puede aumentar la velocidad de reacción.
Se ha informado que la d-tagatosa, l-ribulosa y -d-allulosa tienen tasas máximas de conversión de 74, 89 y 64%, respectivamente, en presencia de ácido bórico. La adición de ácido bórico al proceso de producción de cetosa puede romper el equilibrio químico original y aumentar el rendimiento del producto objetivo. El ácido bórico en la solución de conversión se elimina de un complejo carbocarboborato utilizando una columna especial de intercambio iónico de borato [20], que no afecta a la pureza del producto. Según Noora et al. [18], el rendimiento de d-tagatosa fue de 74% usando L-AI derivado de Thermotoga neapolitana a 60°C, pH 9,0, y con la adición de ácido bórico, que fue 24% mayor que el grupo control sin ácido bórico. Fu Fenggen et al. [19] investigaron el efecto de la relación molar de ácido bórico a sustrsobre el rendimiento en el sistema de reacción de isomerien un estudio sobre la producción de d-tagatosa por células de Escherichia coli recombininmoviliz. Los resultados mostraron que la adición de una cantidad adecuada de ácido bórico puede cambiar el equilibrio químico original y lograr altos rendimientos de d-tagatosa.
2. 6 separación y purificación de la d-tagatosa
Both the bioconversion and chemical conversion methods use D-galactose as the raw material, and the final reaction product is a mixture of D-tagatose and D-galactose. Therefore, the separation and purification of D-tagatose is also a factor affecting the yield of D-tagatose.
Los métodos de separación comúnmente utilizados incluyen cromatode intercambio catiónico o separación de resina simple. Huang Wenxia et al. [21] usaron cromatode resina de intercambio ica2 + y desaliniy decoloración de resina de intercambio catiónico para separar y purid-tagatose. La tasa de recuperación de d-tagatosa alcanzó el 83%, y la pureza alcanzó el 98. El principio de separación se basa principalmente en la diferencia en el grado de complejación de diferentes monosacáridos con Ca2 + para separar y purilos. También se ha informado en la literatura que la d-tagatosa puede ser puridegradselectivamente d-galactosa usando una célula de levadura de cerveza (Saccharomyces cerevisiae L1). La pureza de la d-tagatosa obtenida por este método puede alcanzar más del 95%. Aunque la d-galactosa no reaccionada no puede ser recuperada para su reutilización, este método tiene las ventajas de una alta eficiencia de separación, bajo costo y operación sencilla, proporcionando más opciones para la producción industrial de d-tagatosa.
3. Aplicaciones de la d-tagatosa
3.1. Aplicaciones en alimentos
Because D-tagatose has physical properties and sweetness similar to sucrose, and also has physical and chemical properties such as Ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácido ácidoresistance, alkali resistance and heat resistance, it has broad application prospects in the food industry as a functional sweetener. It can be used in healthy drinks, yogurt, chocolate, chewing gum, foods for diabetics, diet foods, cereal foods, etc.
Actualmente, los principales edulcorantes utilizados comúnmente en la industria de las bebidas son el ciclamato, aspartamo, sacarina, acesulfame, stevia, etc. Todos estos son edulcorantes fuertes que son propensos a producir resabores indeseables como sabores metálicos, amargos y astringentes. Sin embargo, la adición de tagatosa no causa ningún regusto indeseable. Además, la d-tagatosa es un buen prebiótico que puede ser fermentado y utilizado por probióticos, promoviendo el crecimiento de probióticos como Lactobacillus casei y Lactobacillus rhamnosus.

Studies have shown that D-tagatose can promote the growth of Lactobacillus casei and Lactobacillus rhamnosus, improve their beneficial activity and survival rate in the intestine. Therefore, D-tagatose can be used in probiotic supplements and also in yogurt, where it provides sweetness while increasing the number of live bacteria in the yogurt, enhancing its nutritional value and giving it a richer, fuller flavor. In 2001, the US Food and Drug Administration officially approved the use of D-tagatose as a sweetener in the food and beverage industry. In 2003, PepsiCo began using tagatose in Sprite drinks, and since then it has been widely used in the United States as a substitute for sucrose in healthy drinks, yogurt, fruit juice and other products.
La tagatosa Dtiene la característica de ser propensa a la caramelización a bajas temperaturas. Estudios han encontrado que la d-tagatosa sufre una reacción de Maillard con aminoácidos para producir sustancias volátiles como 2-acetilfurano, 2-etilpirazina, 2-acetiltiazol y otras sustancias volátiles que reducen azúcares como la glucosa y la galactosa [22]. Se utiliza en productos horneados no sólo para producir un color ideal, sino también un sabor más suave. Debido a que la tagatosa tiene menor viscoque la sacarosa y se cristaliza fácilmente, si se utiliza para hacer hielo y se aplica a la superficie de los alimentos de cereales, puede aumentar la dulzura del producto y extender su vida útil.
3. 2 Aplicaciones en medicina, cosmética y otros campos
La d-tagatosa puede usarse en medicina como tratamiento para la diabetes tipo 2. Los estudios han demostrado que la d-tagatosa puede reducir los síntomas de la diabetes tipo 2 mediante la reducción de peso corporal y el aumento del contenido de lipoproteína de alta densidad (HLP). También puede usarse en jarabe para la tos, adhedentales y desinfectantes orales. La d-tagatosa se usa en cosméticos como estabilizador e hidratante. Debido a que la d-tagatosa es eficaz contra la caries dental y el mal aliento, puede usarse en dentdenty enjuague bucal. Actualmente, muchas pastas dentales utilizan D-sorbitol o glicer, o ambos, como humectantes. Sin embargo, el D-sorbitol es sólo la mitad de dulce que la sacarosa, mientras que la d-tagatosa es tan dulce como la sacarosa y tiene una higroscopicidad similar al sorbitol. La adición de d-tagatosa a la pasta de dientes y enjuague bucal puede mejorar la dulzura y satisfacer los requisitos de sabor, manteniendo una buena humectación y estabilidad.
referencia
[1] Levin Levin Levin Levin G V. Tagatose, a Nuevo nuevo GRAS sweetener and health Producto [J]. J Med Food,2002,5 :23 — 36.
[2] Oh D K. Tagatose: Propiedad, Solicitud, and Procesos biotecnológicos [J]. Appl Microbiol Biotechnol,2007,76:1-8.
[3] Mu Wanmeng, Zhang Tao, Jiang Bo, et al. D - progreso de la investigación sobre la tagatosa y l-arabinosa isomerasa [J]. Food and fermentación Industry, 2007, 33: 84-90.
[4] Wong D. edulcorantes determined safe in Medicamentos, enjuagues bucales y pastas dentales [J]. Dent Today,2000,19:32,34 — 35.
[5] Liang Min, Zhai Yafei, Zou Yang, et al. Aplicación y producción del nuevo edulcortagatose [J]. Food and Drugs, 2011, 13: 125-128.
[6] Cheetham P S, Wootton un N. bioconversión D — galactosa into D- tagatose [J]. Enzima enzima Microb Technol,1993,15:105 — 108.
[7] Chouaye k h H, Bejar W, Rhimi M, et Al. Caracterización caracterización caracterización of An L arabinose (en inglés) isomerasa desde the Lactobacillus plantarum Tensión NC 8 mostrando pronunciado estabilidad at Ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos pH [J]. FEMS Microbiol Lett,2007,277 :260-267.
[8] Rhimi M, Ilhammami R, Bajic G, et Al. The acid tolerante L arabinosa L isomerasa de la calidad alimentaria Lactobacillus sakei 23 K es un atractivo D-tagatose productor [J]. Bioresour Tecnol, 2010, 101:9171-9177.
[9] Xu Z, Qing Y J, Li S, et Al. A Novela novela L-arabinose isomerasa De Lactobacillus fermentum CGMCC2921 for D-tagatose Producción: clonación de genes, purificación y caracterización [J]. JMol cataiB: Enzym,2011,70:1 — 7.
[10] Rhimi M, Juy M, Aghajari N, et al. Probing the Residuos catalíticos esenciales and the substrate La afinafinidad in the Termoactivo termoactivo Bacillus stearothermophilus US100 L-arabinose isomerasa by Mutagenesis dirigida al lugar [J]. J Bacteriol 2007,189:3556 — 3563.
[11] Kim Kim KimKim Kim P. Current estudios Sobre la producción biológica de tagatosa usando L -arabinosa isomerasa: a revisión and futuro Perspectiva desde perspectiva [J]. ApplMicrobiol Biotechnol,2004,65 :243 — 249.
[12] Kim Yoon S H, Seo M J, et Al. mejora of Conversión de tagatosa rate by Genética genética Evolución evolución of termoestable Galactosa isomerasa [J]. biotecnol Appl Biochem2001,34 :99-102.
[13] Kim H J, Kim J Oh, Oh H J, et al. Caracterización caracterización caracterización of a Geobacillus mutado stearothermophilus L-arabinose isomerasa Que aumenta la tasa de producción de d-tagatosa [J]. J Appl Microbiol, 2006,101:213-221.
[14] Oh H J, Kim H J, Oh K. Aumento de la tasa de producción de d-tagatosa por sitio dirigido mutagenesis L-arabinose isomerasa De Geobacillus thermodenitrificans [J]. biotecnol Lett 2006, 28:145 — 149.
[15]Oh D K. Tagatose: propiedades, aplicaciones, y Procesos biotecnológicos [J]. Appl Microbiotechnol,2007,76:1-8.
[16] Oh D K, Oh H J, Kim H J, et al. Modificación del pH óptimo en L arabinosa isomerasa desde Geobacillus stearothermophilus for D - isomeride de galactosa [J]. J Mol Catal B-Enzym,2006,43 :108 112.
[17] Xu Z, Li S, Fu F, et Al. producción of D-tagatose, a Edulcorfuncional, utilizando alginato ImmobilizedLactobacillus fermentumCGMCC2921Cells [J]. Appl Biochem Biotechnol, 2012,166 :961-973.
[18] Noora S, Kalle S, Matti L, et Al. D-Tagatose production in the
Presencia de borato by En descanso Lactococcus lactis Células células Alberboring Bifidobacterium longum L-arabinose isomerasa [J]. Bioprocess Biosyst Eng,2013,36:489-497.
[19] Fu Fenggen, Xu Zheng, Li Guixiang, et al. Producción de d-tagatosa utilizando células de Escherichia coli recombininmoviliz[J]. Chinese Journal of Bioengineering, 2011, 31: 85-90.
[20] Hicks K B, Simpson G L, Bradbury A G. remoremoremoremoremoremoremoremoremoremoremoremoremoción of bórico Ácido ácido y relacionados Compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos compuestos desde Soluciones soluciones of Carbohy -drates Con boro - selectivo Resina (IRA - 743) [J]. Carbohydr Res,1986, 147 :39-48.
[21] Huang Wenxia, Mu Wanmeng, Jiang Bo. Separación y purificación de d-tagatosa [J]. Food and fermentación Industry, 2008, 34: 168-171.
[22] In H D, Sarah L, Hae-Roung J, et Al. Comparación comparación of «Volátil Maillard» (en inglés). Reacción reacción productos desde Tagatose and Los demás Azúcares reduc with aminoácidos Ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos ácidos [J]. Food Sci. Biotecnol,2010, 19: 431-438.


 inglés
inglés francés
francés español
español ruso
ruso coreano
coreano Japonés japonés
Japonés japonés




